Valensi atom dalam molekul menunjukkan. Apakah itu valensi: bagaimana untuk menentukan dan cara menggunakannya
Konsep "valensi" telah dibentuk dalam kimia sejak awal abad ke-19. Saintis Inggeris E. Frankland menyedari bahawa semua unsur hanya boleh membentuk bilangan ikatan tertentu dengan atom unsur lain. Dia memanggilnya "daya penghubung." Kemudian, saintis Jerman F.A. Kekule mengkaji metana dan membuat kesimpulan bahawa satu atom karbon boleh melekat hanya empat atom hidrogen dalam keadaan normal.
Dia menyebutnya asasi. Asas karbon adalah empat. Iaitu, karbon boleh membentuk empat ikatan dengan unsur lain.
Bersentuhan dengan
Rakan sekelas
Konsep ini dikembangkan lagi dalam karya D.I. Mendeleev. Dmitry Ivanovich mengembangkan doktrin perubahan berkala dalam sifat bahan mudah. Beliau mentakrifkan daya penghubung sebagai keupayaan unsur untuk melekatkan sejumlah atom unsur lain.
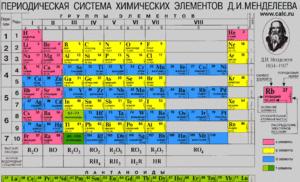
Penentuan daripada jadual berkala
Jadual berkala memudahkan untuk menentukan asas unsur. Untuk ini anda perlukan boleh membaca jadual berkala. Jadual mempunyai lapan kumpulan secara menegak, dan noktah disusun secara mendatar. Jika tempoh terdiri daripada dua baris, maka ia dipanggil besar, dan jika ia terdiri daripada satu, ia dipanggil kecil. Elemen diedarkan secara tidak sekata secara menegak dalam lajur dan kumpulan. Valensi sentiasa ditunjukkan dengan angka Rom.
Untuk menentukan valensi, anda perlu tahu apa itu. Bagi logam subkumpulan utama ia sentiasa malar, tetapi bagi bukan logam dan logam subkumpulan sekunder ia boleh berubah-ubah.
Pemalar adalah sama dengan nombor kumpulan. Pembolehubah boleh lebih tinggi atau lebih rendah. Pembolehubah tertinggi adalah sama dengan nombor kumpulan, dan yang rendah dikira dengan formula: lapan tolak nombor kumpulan . Apabila menentukan, anda perlu ingat:
- untuk hidrogen ia sama dengan I;
- untuk oksigen - II.
Jika sebatian mempunyai atom hidrogen atau oksigen, maka menentukan valensinya tidak sukar, terutamanya jika kita mempunyai hidrida atau oksida.
Formula dan algoritma
Valensi terendah adalah untuk elemen yang terletak di sebelah kanan dan lebih tinggi dalam jadual. Dan, sebaliknya, jika elemen lebih rendah dan ke kiri, maka ia akan lebih tinggi. Untuk mentakrifkannya, anda perlu mengikuti algoritma universal:

Contoh: mari kita ambil sebatian ammonia - NH3. Kita tahu bahawa atom hidrogen mempunyai valens malar dan sama dengan I. Kita darabkan I dengan 3 (bilangan atom) - gandaan terkecil ialah 3. Nitrogen dalam formula ini mempunyai indeks satu. Oleh itu kesimpulannya: kita bahagikan 3 dengan 1 dan kita dapati bahawa untuk nitrogen ia adalah sama dengan IIII.
Nilai hidrogen dan oksigen sentiasa mudah ditentukan. Ia lebih sukar apabila ia perlu ditentukan tanpa mereka. Sebagai contoh , sebatian SiCl4. Bagaimana untuk menentukan valensi unsur dalam kes ini? Klorin berada dalam kumpulan 7. Ini bermakna valensinya adalah sama ada 7 atau 1 (lapan tolak nombor kumpulan). Silikon berada dalam kumpulan keempat, yang bermaksud potensinya untuk membentuk ikatan adalah empat. Menjadi logik bahawa klorin mempamerkan valensi terendah dalam keadaan ini dan ia sama dengan I.
Buku teks kimia moden sentiasa mengandungi jadual valensi unsur kimia. Ini menjadikan tugasan lebih mudah untuk pelajar. Topik ini dipelajari dalam gred kelapan - dalam kursus kimia bukan organik.
Perwakilan moden
 Idea moden tentang valensi berdasarkan struktur atom. Atom terdiri daripada nukleus dan elektron berputar dalam orbital.
Idea moden tentang valensi berdasarkan struktur atom. Atom terdiri daripada nukleus dan elektron berputar dalam orbital.
Nukleus itu sendiri terdiri daripada proton dan neutron, yang menentukan berat atom. Untuk bahan menjadi stabil, tahap tenaganya mesti diisi dan mempunyai lapan elektron.
Apabila berinteraksi, unsur berusaha untuk kestabilan dan sama ada melepaskan elektron yang tidak berpasangan atau menerimanya. Interaksi berlaku mengikut prinsip "yang mana lebih mudah" - memberi atau menerima elektron. Ini juga menentukan bagaimana valensi berubah dalam jadual berkala. Bilangan elektron tidak berpasangan dalam orbital tenaga luar adalah sama dengan nombor kumpulan.
Sebagai contoh
Natrium logam alkali berada dalam kumpulan pertama jadual berkala Mendeleev. Ini bermakna ia mempunyai satu elektron tidak berpasangan dalam tahap tenaga luarnya. Klorin berada dalam kumpulan ketujuh. Ini bermakna klorin mempunyai tujuh elektron tidak berpasangan. Klorin memerlukan tepat satu elektron untuk melengkapkan tahap tenaganya. Natrium menyerahkan elektronnya kepadanya dan menjadi stabil dalam sebatian. Klorin mendapat elektron tambahan dan juga menjadi stabil. Akibatnya, ikatan dan sambungan yang kuat muncul - NaCl - garam meja yang terkenal. Valensi klorin dan natrium dalam kes ini akan sama dengan 1.
Dalam artikel ini kita akan melihat kaedah dan memahami bagaimana untuk menentukan valens unsur jadual berkala.
Dalam kimia, diterima bahawa valensi unsur kimia boleh ditentukan oleh kumpulan (lajur) dalam jadual berkala. Pada hakikatnya, valensi unsur tidak selalu sepadan dengan nombor kumpulan, tetapi dalam kebanyakan kes, valensi tertentu menggunakan kaedah ini akan memberikan hasil yang betul; selalunya unsur, bergantung kepada pelbagai faktor, mempunyai lebih daripada satu valensi.
Unit valens diambil sebagai valensi atom hidrogen bersamaan dengan 1, iaitu, hidrogen adalah monovalen. Oleh itu, valensi unsur menunjukkan berapa banyak atom hidrogen satu atom unsur yang berkenaan disambungkan. Sebagai contoh, HCl, di mana klorin adalah monovalen; H2O, di mana oksigen adalah divalen; NH3, di mana nitrogen adalah trivalen.
Bagaimana untuk menentukan valensi menggunakan jadual berkala.
Jadual berkala mengandungi unsur kimia yang diletakkan di dalamnya mengikut prinsip dan undang-undang tertentu. Setiap elemen berdiri di tempatnya, yang ditentukan oleh ciri dan sifatnya, dan setiap elemen mempunyai nombornya sendiri. Garis mendatar dipanggil titik, yang meningkat dari baris pertama ke bawah. Jika tempoh terdiri daripada dua baris (seperti yang ditunjukkan oleh penomboran di sebelah), maka tempoh sedemikian dipanggil besar. Jika ia hanya mempunyai satu baris, ia dipanggil kecil.
Di samping itu, terdapat kumpulan dalam jadual, di mana terdapat lapan jumlahnya. Elemen diletakkan dalam lajur menegak. Di sini penempatan mereka tidak sekata - di satu pihak terdapat lebih banyak elemen (kumpulan utama), di sisi lain - lebih sedikit (kumpulan sampingan).
Valensi ialah keupayaan atom untuk membentuk sejumlah ikatan kimia dengan atom unsur lain. menggunakan jadual berkala akan membantu anda memahami pengetahuan tentang jenis valensi.
Untuk unsur subkumpulan sekunder (dan ini termasuk hanya logam), valensi mesti diingat, terutamanya kerana dalam kebanyakan kes ia sama dengan I, II, kurang kerap III. Anda juga perlu menghafal valensi unsur kimia yang mempunyai lebih daripada dua makna. Atau simpan jadual valens unsur di tangan pada setiap masa.
Algoritma untuk menentukan valensi menggunakan formula unsur kimia.
1. Tuliskan formula sebatian kimia.
2. Tentukan valens unsur yang diketahui.
3. Cari gandaan sepunya terkecil bagi valency dan indeks.
4. Cari nisbah gandaan sepunya terkecil kepada bilangan atom unsur kedua. Ini adalah valensi yang dikehendaki.
5. Semak dengan mendarab valens dan indeks setiap unsur. Produk mereka mestilah sama.
Contoh: Mari kita tentukan valens unsur hidrogen sulfida.
1. Mari kita tulis formula:
2. Mari kita nyatakan valensi yang diketahui:
3. Cari gandaan sepunya terkecil:
4. Cari nisbah gandaan sepunya terkecil kepada bilangan atom sulfur:
5. Mari kita semak:
Jadual nilai valens ciri beberapa atom sebatian kimia.
|
elemen |
Valence |
Contoh sambungan |
|
H 2 , HF, Li 2 O, NaCl, KBr |
||
|
O, Mg, Ca, Sr, Ba, Zn |
H 2 O, MgCl 2, CaH 2, SrBr 2, BaO, ZnCl 2 |
|
|
CO 2, CH4, SiO 2, SiCl 4 |
||
|
CrCl 2, CrCl 3, CrO 3 |
||
|
H 2 S, SO 2, SO3 |
||
|
NH 3 , NH 4 Cl, HNO 3 |
||
|
PH 3, P 2 O 5, H 3 PO 4 |
||
|
SnCl 2, SnCl 4, PbO, PbO 2 |
||
|
HCl, ClF 3, BrF 5, IF 7 |
Di dunia di sekeliling kita, atom individu unsur kimia "dengan sendirinya" sangat jarang wujud; sebagai peraturan, atom unsur yang berbeza bergabung antara satu sama lain untuk membentuk molekul.
Jika beberapa atom yang sama digabungkan bersama, bahan ringkas diperoleh (sains moden mengetahui kira-kira 500 bahan ringkas), tetapi lebih kerap atom yang berbeza digabungkan bersama untuk membentuk bahan kompleks (lihat teori atom-molekul).
Contoh bahan ringkas: O 2 (oksigen), O 3 (ozon).
Contoh bahan kompleks: NaCl (garam meja), H 2 SO 4 (asid sulfurik), H 2 O (air).

Komposisi dan struktur molekul diterangkan menggunakan formula kimia, yang menunjukkan unsur kimia yang termasuk dalam bahan, serta berapa banyak atom unsur kimia tertentu yang termasuk dalam molekul bahan. Contohnya, molekul asid sulfurik (H 2 SO 4) mengandungi hidrogen (2 atom), sulfur (1 atom), oksigen (4 atom).
Menggunakan formula kimia, sangat mudah untuk menentukan jisim molekul bahan, yang sama dengan jumlah jisim atom.
Berat molekul asid sulfurik ialah: H 2 SO 4 = 1 2 + 32 + 16 4 = 98.
Satu lagi ciri kuantitatif yang sangat penting bagi atom yang berinteraksi antara satu sama lain ialah valens.
Valensi ditentukan oleh bilangan ikatan yang terbentuk oleh atom dengan atom lain. Untuk menulis formula bahan yang betul, anda perlu mengetahui valensi atom yang termasuk dalam bahan ini.
Dalam formula struktur, ikatan kimia antara atom ditunjukkan dengan garis (lihat formula untuk ikatan kovalen), dan setiap ikatan kimia dibentuk oleh dua elektron atom jiran (setiap atom memperuntukkan satu elektron sendiri untuk tujuan ini, terletak di bahagian paling luar. orbital). Oleh itu, valensi atom (bilangan ikatan yang boleh dibentuk oleh atom dengan atom jiran) ditentukan oleh bilangan elektron valens yang tidak berpasangan.
Sesetengah unsur kimia sentiasa mempamerkan valensi malar:






Unsur lain mempunyai valensi berubah-ubah.

Valensi bagi atom yang tidak diketahui bagi sesuatu bahan boleh ditentukan daripada atom lain dengan valensi diketahui yang merupakan sebahagian daripada bahan ini.
Sebagai contoh, sulfur boleh mempunyai valens 2, 4, 6.

Mari tentukan apakah valensi sulfur dalam sebatian: H 2 S, SO 2, SO 3?
Adalah diketahui bahawa valensi hidrogen = 1, dan valensi oksigen = 2. Untuk menyelesaikan masalah, adalah perlu untuk mendarabkan valensi atom yang diketahui dengan bilangan atom ini yang termasuk dalam bahan: H 2 = 2 ; O 2 = 4; O 3 = 6. Oleh kerana dalam semua formula hanya terdapat satu atom sulfur, nombor yang terhasil akan menunjukkan valensi sulfur dalam formula ini.
Mengetahui valensi semua unsur yang termasuk dalam bahan, anda boleh mencipta formula kimia bahan yang betul. Untuk melakukan ini, anda mesti mencari gandaan sepunya terkecil dahulu, dan kemudian, untuk menentukan bilangan atom unsur tertentu, bahagikan gandaan sepunya terkecil dengan valens setiap atom yang termasuk dalam formula.
Sebagai contoh, fosforus oksida mengandungi fosforus (valensi 5) dan oksigen (2). Gandaan sepunya terkecil ialah 5 2 = 10. 10/5 = 2; 10/2 = 5. Kami mendapat formula P 2 O 5.
Mengapakah sesetengah atom boleh mempunyai hanya satu valensi, manakala yang lain mempunyai beberapa? Untuk jawapan kepada soalan ini, lihat
Unsur kimia yang berbeza berbeza dalam keupayaan mereka untuk membentuk ikatan kimia, iaitu, untuk bergabung dengan atom lain. Oleh itu, dalam bahan kompleks mereka hanya boleh hadir dalam perkadaran tertentu. Mari kita fikirkan cara menentukan valensi menggunakan jadual berkala.
Apakah valens?
Terdapat definisi valens sedemikian: ini adalah keupayaan atom untuk membentuk sejumlah ikatan kimia. Tidak seperti , kuantiti ini sentiasa positif dan dilambangkan dengan angka Rom.
Ciri untuk hidrogen ini digunakan sebagai unit, yang diambil bersamaan dengan I. Sifat ini menunjukkan bilangan atom monovalen yang boleh digabungkan dengan unsur tertentu. Untuk oksigen, nilai ini sentiasa sama dengan II.
Ia adalah perlu untuk mengetahui ciri ini untuk menulis formula kimia bahan dan persamaan dengan betul. Mengetahui nilai ini akan membantu mewujudkan hubungan antara bilangan atom pelbagai jenis dalam molekul.
 Konsep ini berasal dari kimia pada abad ke-19. Frankland memulakan teori yang menerangkan gabungan atom dalam pelbagai perkadaran, tetapi ideanya tentang "daya pengikat" tidak begitu meluas. Peranan yang menentukan dalam perkembangan teori adalah milik Kekula. Dia memanggil sifat membentuk sebilangan ikatan asasi. Kekulé percaya bahawa ini adalah sifat asas dan tidak berubah bagi setiap jenis atom. Butlerov membuat penambahan penting kepada teori. Dengan perkembangan teori ini, ia menjadi mungkin untuk menggambarkan molekul secara visual. Ini sangat membantu dalam mengkaji struktur pelbagai bahan.
Konsep ini berasal dari kimia pada abad ke-19. Frankland memulakan teori yang menerangkan gabungan atom dalam pelbagai perkadaran, tetapi ideanya tentang "daya pengikat" tidak begitu meluas. Peranan yang menentukan dalam perkembangan teori adalah milik Kekula. Dia memanggil sifat membentuk sebilangan ikatan asasi. Kekulé percaya bahawa ini adalah sifat asas dan tidak berubah bagi setiap jenis atom. Butlerov membuat penambahan penting kepada teori. Dengan perkembangan teori ini, ia menjadi mungkin untuk menggambarkan molekul secara visual. Ini sangat membantu dalam mengkaji struktur pelbagai bahan.
Bagaimanakah jadual berkala boleh membantu?
 Anda boleh mencari valency dengan melihat nombor kumpulan dalam versi jangka pendek. Bagi kebanyakan elemen yang ciri ini adalah malar (mengambil hanya satu nilai), ia bertepatan dengan nombor kumpulan.
Anda boleh mencari valency dengan melihat nombor kumpulan dalam versi jangka pendek. Bagi kebanyakan elemen yang ciri ini adalah malar (mengambil hanya satu nilai), ia bertepatan dengan nombor kumpulan.
Sifat sedemikian mempunyai subkumpulan utama. kenapa? Nombor kumpulan sepadan dengan bilangan elektron dalam kulit luar. Elektron ini dipanggil elektron valens. Mereka bertanggungjawab untuk keupayaan untuk berhubung dengan atom lain.
Kumpulan ini terdiri daripada unsur-unsur dengan struktur cangkerang elektronik yang serupa, dan cas nuklear meningkat dari atas ke bawah. Dalam bentuk jangka pendek, setiap kumpulan dibahagikan kepada subkumpulan utama dan sekunder. Wakil subkumpulan utama ialah unsur s dan p, wakil subkumpulan sampingan mempunyai elektron dalam orbital d dan f.
Bagaimana untuk menentukan valens unsur kimia jika ia berubah? Ia boleh bertepatan dengan nombor kumpulan atau sama dengan nombor kumpulan tolak lapan, dan juga mengambil nilai lain.
Penting! Semakin tinggi dan ke kanan elemen, semakin kurang keupayaannya untuk membentuk hubungan. Semakin ia dianjak ke bawah dan ke kiri, semakin besar ia.
 Cara valensi berubah dalam jadual berkala untuk jenis atom tertentu bergantung pada struktur kulit elektronnya. Sulfur, sebagai contoh, boleh menjadi di-, tetra- dan heksavalen.
Cara valensi berubah dalam jadual berkala untuk jenis atom tertentu bergantung pada struktur kulit elektronnya. Sulfur, sebagai contoh, boleh menjadi di-, tetra- dan heksavalen.
Dalam keadaan tanah (tidak teruja) sulfur, dua elektron tidak berpasangan terletak dalam subaras 3p. Dalam keadaan ini, ia boleh bergabung dengan dua atom hidrogen dan membentuk hidrogen sulfida. Jika sulfur masuk ke dalam keadaan yang lebih teruja, maka satu elektron akan bergerak ke sublevel 3d bebas, dan akan ada 4 elektron tidak berpasangan.
Sulfur akan menjadi tetravalen. Jika anda memberikannya lebih banyak tenaga, maka elektron lain akan bergerak dari subperingkat 3s kepada 3d. Sulfur akan menjadi lebih teruja dan menjadi heksavalen.
Malar dan berubah-ubah
Kadangkala keupayaan untuk membentuk ikatan kimia mungkin berubah. Ia bergantung pada kompaun mana unsur itu dimasukkan. Sebagai contoh, sulfur dalam H2S adalah divalen, dalam SO2 ia tetravalen, dan dalam SO3 ia heksavalen. Yang terbesar daripada nilai ini dipanggil tertinggi, dan yang terkecil dipanggil terendah. Valensi tertinggi dan terendah mengikut jadual berkala boleh ditubuhkan seperti berikut: yang tertinggi bertepatan dengan nombor kumpulan, dan yang terendah adalah sama dengan 8 tolak nombor kumpulan.
 Bagaimana untuk menentukan valens unsur kimia dan sama ada ia berubah? Kita perlu menentukan sama ada kita berurusan dengan logam atau bukan logam. Jika ia adalah logam, anda perlu menentukan sama ada ia tergolong dalam subkumpulan utama atau sekunder.
Bagaimana untuk menentukan valens unsur kimia dan sama ada ia berubah? Kita perlu menentukan sama ada kita berurusan dengan logam atau bukan logam. Jika ia adalah logam, anda perlu menentukan sama ada ia tergolong dalam subkumpulan utama atau sekunder.
- Logam subkumpulan utama mempunyai keupayaan berterusan untuk membentuk ikatan kimia.
- Untuk logam subkumpulan sekunder - berubah-ubah.
- Bagi bukan logam ia juga berubah-ubah. Dalam kebanyakan kes, ia memerlukan dua makna - lebih tinggi dan lebih rendah, tetapi kadangkala terdapat lebih banyak pilihan. Contohnya ialah sulfur, klorin, bromin, iodin, kromium dan lain-lain.
Dalam sebatian, valensi terendah ditunjukkan oleh unsur yang lebih tinggi dan ke kanan dalam jadual berkala, masing-masing, yang tertinggi adalah yang ke kiri dan lebih rendah.
Selalunya keupayaan untuk membentuk ikatan kimia mengambil lebih daripada dua makna. Kemudian anda tidak akan dapat mengenalinya daripada jadual, tetapi anda perlu mempelajarinya. Contoh bahan tersebut:
- karbon;
- sulfur;
- klorin;
- bromin.
Bagaimana untuk menentukan valens unsur dalam formula sebatian? Jika ia diketahui untuk komponen lain bahan, ini tidak sukar. Sebagai contoh, anda perlu mengira sifat ini untuk klorin dalam NaCl. Natrium ialah unsur subkumpulan utama kumpulan pertama, jadi ia adalah monovalen. Akibatnya, klorin dalam bahan ini juga boleh mencipta hanya satu ikatan dan juga monovalen.
Penting! Walau bagaimanapun, tidak selalu mungkin untuk mengetahui sifat ini untuk semua atom dalam bahan kompleks. Mari kita ambil HClO4 sebagai contoh. Mengetahui sifat hidrogen, kita hanya boleh memastikan bahawa ClO4 adalah sisa monovalen.
Bagaimana lagi anda boleh mengetahui nilai ini?
Keupayaan untuk membentuk bilangan sambungan tertentu tidak selalunya bertepatan dengan nombor kumpulan, dan dalam beberapa kes ia hanya perlu dipelajari. Di sini jadual valensi unsur kimia akan datang untuk menyelamatkan, yang menunjukkan nilai nilai ini. Buku teks kimia gred ke-8 menyediakan nilai untuk keupayaan untuk bergabung dengan atom lain daripada jenis atom yang paling biasa.
| H, F, Li, Na, K | 1 |
| O, Mg, Ca, Ba, Sr, Zn | 2 |
| B, Al | 3 |
| C, Si | 4 |
| Cu | 1, 2 |
| Fe | 2, 3 |
| Cr | 2, 3, 6 |
| S | 2, 4, 6 |
| N | 3, 4 |
| P | 3, 5 |
| Sn, Pb | 2, 4 |
| Cl, Br, I | 1, 3, 5, 7 |
Permohonan
 Perlu dikatakan bahawa ahli kimia pada masa ini hampir tidak menggunakan konsep valensi mengikut jadual berkala. Sebaliknya, konsep keadaan pengoksidaan digunakan untuk keupayaan bahan membentuk bilangan hubungan tertentu, untuk bahan dengan struktur - kovalen, dan untuk bahan dengan struktur ionik - cas ion.
Perlu dikatakan bahawa ahli kimia pada masa ini hampir tidak menggunakan konsep valensi mengikut jadual berkala. Sebaliknya, konsep keadaan pengoksidaan digunakan untuk keupayaan bahan membentuk bilangan hubungan tertentu, untuk bahan dengan struktur - kovalen, dan untuk bahan dengan struktur ionik - cas ion.
Walau bagaimanapun, konsep yang sedang dipertimbangkan digunakan untuk tujuan metodologi. Dengan bantuannya, adalah mudah untuk menerangkan mengapa atom pelbagai jenis bergabung dalam nisbah yang kita perhatikan, dan mengapa nisbah ini berbeza untuk sebatian yang berbeza.
Pada masa ini, pendekatan mengikut mana gabungan unsur-unsur menjadi bahan baru sentiasa dijelaskan menggunakan valensi mengikut jadual berkala, tanpa mengira jenis ikatan dalam sebatian, adalah ketinggalan zaman. Sekarang kita tahu bahawa untuk ikatan ionik, kovalen, dan logam terdapat mekanisme yang berbeza untuk menggabungkan atom menjadi molekul.
Video yang berguna
Mari kita ringkaskan
Menggunakan jadual berkala, adalah tidak mungkin untuk menentukan keupayaan untuk membentuk ikatan kimia untuk semua unsur. Bagi mereka yang mempamerkan satu valensi mengikut jadual berkala, dalam kebanyakan kes ia adalah sama dengan nombor kumpulan. Jika terdapat dua pilihan untuk nilai ini, maka ia boleh sama dengan nombor kumpulan atau lapan tolak nombor kumpulan. Terdapat juga jadual khas yang membolehkan anda mengetahui ciri ini.
Bersentuhan dengan
Valensi ialah keupayaan atom untuk melekat pada diri mereka sendiri sejumlah atom lain.
Satu atom unsur monovalen yang lain digabungkan dengan satu atom unsur monovalen(HCl) . Atom unsur divalen bergabung dengan dua atom unsur monovalen.(H2O) atau satu atom divalen(CaO) . Ini bermakna bahawa valens unsur boleh diwakili sebagai nombor yang menunjukkan berapa banyak atom unsur monovalen yang boleh digabungkan dengan atom unsur tertentu. Valensi unsur ialah bilangan ikatan yang terbentuk oleh atom:
Na - monovalen (satu ikatan)
H - monovalen (satu ikatan)
O – divalen (dua ikatan untuk setiap atom)
S – heksavalen (membentuk enam ikatan dengan atom jiran)
Peraturan untuk menentukan valens
elemen dalam perkaitan
1. Valence hidrogen tersalah anggap saya(unit). Kemudian, mengikut formula air H 2 O, dua atom hidrogen dilekatkan pada satu atom oksigen.
2. Oksigen dalam sebatiannya sentiasa mempamerkan valens II. Oleh itu, karbon dalam sebatian CO 2 (karbon dioksida) mempunyai valens IV.
3. Valensi yang lebih tinggi sama dengan nombor kumpulan .
4. Valensi terendah adalah sama dengan perbezaan antara nombor 8 (bilangan kumpulan dalam jadual) dan bilangan kumpulan di mana unsur ini terletak, i.e. 8 - N kumpulan .
5. Bagi logam yang terletak dalam subkumpulan "A", valens adalah sama dengan nombor kumpulan.
6. Bukan logam biasanya mempamerkan dua valens: lebih tinggi dan lebih rendah.
Contohnya: sulfur mempunyai valensi tertinggi VI dan yang paling rendah (8 – 6) bersamaan dengan II; fosforus mempamerkan valens V dan III.
7. Valensi boleh menjadi malar atau berubah-ubah.
Valensi unsur mesti diketahui untuk menyusun formula kimia sebatian.
Algoritma untuk menyusun formula sebatian fosforus oksida
|
Urutan |
Merumuskan fosforus oksida |
|
1. Tulis simbol unsur |
R O |
|
2. Tentukan valensi unsur |
V II |
|
3. Cari gandaan sepunya terkecil bagi nilai berangka valens |
5 2 = 10 |
|
4. Cari hubungan antara atom unsur dengan membahagikan gandaan terkecil yang ditemui dengan valens unsur yang sepadan |
10: 5 = 2, 10: 2 = 5; P:O=2:5 |
|
5. Tulis indeks untuk simbol unsur |
R 2 O 5 |
|
6. Formula sebatian (oksida) |
R 2 O 5 |
Ingat!
Ciri menyusun formula kimia sebatian.
1) Valensi terendah ditunjukkan oleh unsur yang terletak di sebelah kanan dan atas dalam jadual D.I. Mendeleev, dan valens tertinggi ditunjukkan oleh unsur yang terletak di sebelah kiri dan bawah.
Sebagai contoh, dalam kombinasi dengan oksigen, sulfur mempamerkan valensi VI tertinggi, dan oksigen valensi II terendah. Oleh itu, formula untuk sulfur oksida ialah JADI 3.
Dalam sebatian silikon dengan karbon, yang pertama mempamerkan valensi IV tertinggi, dan yang kedua - IV terendah. Jadi formulanya
– SiC. Ini adalah silikon karbida, asas bahan refraktori dan kasar.
2) Atom logam didahulukan dalam formula.
2) Dalam formula sebatian, atom bukan logam yang mempamerkan valensi terendah sentiasa berada di tempat kedua, dan nama sebatian sedemikian berakhir dengan "id".
Sebagai contoh,Sao - kalsium oksida, NaCl - natrium klorida, PbS – plumbum sulfida.
Kini anda boleh menulis formula untuk sebarang sebatian logam dan bukan logam.