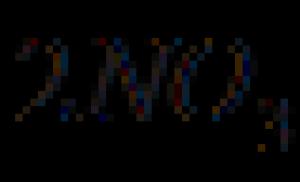የተበታተኑ ስርዓቶችን, ምደባቸውን እና አጭር ባህሪያትን የማግኘት ዘዴዎች. ከቴርሞዳይናሚክ እይታ አንጻር የትኛው የተበታተኑ ስርዓቶችን የማግኘት ዘዴ በጣም ጠቃሚ ነው? የተበታተኑ ስርዓቶችን ለማግኘት የአየር ማቀዝቀዣ ዘዴዎች የተበታተኑ ስርዓቶችን ለማግኘት ዘዴዎች
9. በምላሹ በ isobaric-isothermal አቅም ላይ ያለውን ለውጥ ይወስኑ N 2 (g) + 2H 2 O (l) = NH 4 NO 2 (l) እና በመደበኛ ሁኔታዎች ውስጥ ስለ ፍሰቱ አቅጣጫ መደምደሚያ ይስጡ, ለ H 2 O (l) እኩል ከሆነ - 237.4 ኪጄ / ሞል, እና ለኤንኤች 4 NO 2 (l) እኩል ነው - 115.8 ኪጁ / ሞል.
በ isobaric-isothermal አቅም ላይ ያለው ለውጥ ከ 0 ያነሰ ነው, ስለዚህ, ሂደቱ በድንገት ወደ ቀጥተኛ ምላሽ አቅጣጫ ሊቀጥል ይችላል.
14. የተወሰኑ ምሳሌዎችን በመጠቀም የኬሚካላዊ ምላሽን ሞለኪውላዊነት እና ቅደም ተከተል ይወስኑ።
የምላሽ ሞለኪውላራይት የሚወሰነው በተሰጠው ምላሽ የመጀመሪያ ደረጃ ተግባር ውስጥ በተመሳሳይ ጊዜ በሚሳተፉት አነስተኛ የሞለኪውሎች ብዛት ነው። የምላሹ ሞለኪውላዊነት እና ቅደም ተከተል በቁጥር አንድ አይነት ለቀላል ምላሾች ብቻ ነው። ለተወሳሰቡ ሂደቶች, እነዚህ የምላሽ ባህሪያት የተለዩ ይሆናሉ (የምላሹ ቅደም ተከተል ከሞለኪውላዊነቱ ያነሰ ነው). በዚህም ምክንያት በአብዛኛዎቹ ጉዳዮች ላይ የምላሽ ቅደም ተከተል መደበኛ ጽንሰ-ሐሳብ ውስብስብ ስልቱን አያመለክትም, ማለትም. በርካታ መካከለኛ የአንደኛ ደረጃ ምላሾች (ደረጃዎች) መኖራቸው. ሆኖም ፣ የምላሹን የሙከራ ቅደም ተከተል ማወቅ የተሰላ እና በሙከራ የተመለከቱትን የ n እሴቶችን በማነፃፀር የታቀደውን ዘዴ ለመገምገም ያስችላል። በሙከራ የተገኘ የምላሽ ቅደም ተከተል በምላሹ ውስጥ ከሚሳተፉ የሪኤጀንቶች ብዛት ጋር የማይዛመድ ከሆነ ፣ ይህ የሚያሳየው ምላሹ የመጀመሪያ ደረጃ ሂደት አይደለም ፣ ግን ውስብስብ በሆነ ዘዴ ይቀጥላል። ለተወሳሰበ ዘዴ, የአጠቃላይ ምላሽ መጠን የሚወሰነው በባለብዙ ደረጃ ሂደት በጣም ቀርፋፋ ደረጃ ላይ ነው. ስለዚህ, አንድ ምላሽ በአንድ ደረጃ ከቀጠለ, የእሱ ቅደም ተከተል ከሞለኪውላሊቲ ጋር እኩል ነው; ምላሹ በበርካታ ደረጃዎች ከቀጠለ ፣ የእያንዳንዱ የምላሽ ደረጃ ቅደም ተከተል ከዚህ ደረጃ ብቻ ካለው ሞለኪውላዊነት ጋር እኩል ነው። ስለዚህ, የምላሽ ቅደም ተከተል በሙከራ መወሰን የእሱን ዘዴ ለማጥናት እንደ ዘዴ ሆኖ ሊያገለግል ይችላል.
የመጀመሪያ ደረጃ ድርጊትን ለማከናወን አንድ ቅንጣት (ሞለኪውል) ብቻ አስፈላጊ ከሆነ, እንዲህ ዓይነቱ ምላሽ monomolecular ይባላል.
ለአንደኛ ደረጃ ሂደት የሁለት ቅንጣቶች በአንድ ጊዜ ተሳትፎ፣ ምላሹ ቢሞሊኩላር ወዘተ ይባላል።
ለምሳሌ:
ምላሹ monomolecular ነው ፣ የምላሽ ቅደም ተከተል 1/3 ነው።
C (t) + H 2 O (g) CO (g) + H 2 (g)
ምላሹ bimolecular ነው፣ የምላሹ ቅደም ተከተል 2/2= 1 ነው።
![]()
ምላሹ trimolecular ነው ፣ የምላሹ ቅደም ተከተል 2/3 ነው (ከሶስት ሞለኪውሎች ምላሽ ሰጪ ንጥረ ነገሮች ሁለት የምላሽ ምርቶች ሞለኪውሎች ይገኛሉ)።
29. ከኬሚካላዊ ምላሽ ጋር አብሮ የሚመጣው የነፃ ኃይል ለውጥ, ከተመጣጣኝ ቋሚነት ጋር ያለው ግንኙነት. የምላሹን የሙቀት ተፅእኖ ስሌት.
በጊብስ ነፃ ኢነርጂ ለውጥ ወይም በ isobaric-isothermal አቅም ላይ ያለው ለውጥ የስርዓቱ ከፍተኛው የኃይል አካል ሲሆን በተሰጡት ሁኔታዎች ወደ ጠቃሚ ስራ ሊለወጥ ይችላል. ምላሹ በድንገት ሲከሰት.
የዘፈቀደ ምላሽ የጅምላ እርምጃ ህግ መሰረት
a A + b B = c C + d D (1)
ለቀጣይ ምላሽ የዋጋ እኩልነት ሊፃፍ ይችላል-
![]() , (2)
, (2)
እና ለተገላቢጦሽ ምላሽ መጠን
![]() . (3)
. (3)
ምላሽ (1.33) ከግራ ወደ ቀኝ ሲሄድ የ A እና B ንጥረ ነገሮች ክምችት ይቀንሳል እና ወደፊት የሚወስደው ምላሽ መጠን ይቀንሳል. በሌላ በኩል፣ የምላሽ ምርቶች C እና D ሲከማቹ፣ ከቀኝ ወደ ግራ ያለው ምላሽ መጠን ይጨምራል። ፍጥነቶች υ 1 እና υ 2 ተመሳሳይ ሲሆኑ የሁሉም ንጥረ ነገሮች ክምችት ሳይለወጥ የሚቆይበት ጊዜ ይመጣል።
የት ነው K c = k 1 / k 2 = ![]() .
.
የቋሚ እሴት Kc ፣የወደፊቱ እና የተገላቢጦሽ ምላሾች ሬሾ ጋር እኩል የሆነ ፣የሚዛን ሁኔታን በመጠን በመነሻ ንጥረ ነገሮች እና በግንኙነታቸው ምርቶች (እስከ ስቶይቺዮሜትሪ ቅንጅቶች መጠን) እና ሚዛናዊነት ሁኔታን ይገልፃል። ሚዛኑ ቋሚ ይባላል። የተመጣጠነ ቋሚው ቋሚነት ለተወሰነ የሙቀት መጠን ብቻ ነው, ማለትም. K c = f (ቲ) የኬሚካላዊ ምላሽ ሚዛናዊነት ቋሚነት ብዙውን ጊዜ እንደ ሬሾ ይገለጻል, አሃዛዊው የምላሽ ምርቶች ሚዛናዊ የሞላር ክምችት ውጤት ነው, እና መለያው የመነሻ ንጥረ ነገሮች ክምችት ውጤት ነው.
የምላሽ ክፍሎቹ ተስማሚ ጋዞች ድብልቅ ከሆኑ ፣ ከዚያ ሚዛናዊ ቋሚ (K p) በክፍሎቹ ከፊል ግፊቶች ውስጥ ይገለጻል ።
K p = ![]() . (5)
. (5)
ከሒሳብ (6) K p = K c በጋዝ ደረጃ ውስጥ ያሉትን የሞሎች ብዛት ሳይቀይር ምላሹ እንዲቀጥል ካደረገ ፣ ማለትም መቼ (c + d) = (a + b)።
ምላሽ (1) በቋሚ P እና T ወይም V እና T ላይ በድንገት የሚከሰት ከሆነ ፣ የ G እሴቶች እና ይህ ምላሽ ከሚከተለው ቀመር ሊገኝ ይችላል-
የት Р А, Р В, Р С, Р D የመነሻ ንጥረ ነገሮች እና የምላሽ ምርቶች ከፊል ግፊቶች ናቸው.
ቀመር (7) የቫንት ሆፍ ኬሚካላዊ ምላሽ isotherm equations ይባላል። ይህ ግንኙነት የምላሹን G እና F እሴቶችን ለማስላት እና አቅጣጫውን በተለያዩ የመነሻ ንጥረ ነገሮች መጠን ለመወሰን ያስችላል።
ለሁለቱም የጋዝ ስርዓቶች እና መፍትሄዎች ፣ ጠጣሮች በምላሹ ውስጥ ሲሳተፉ (ማለትም ፣ ለ heterogeneous ስርዓቶች) ፣ የጠንካራው ደረጃ ትኩረት በተመጣጣኝ ቋሚ መግለጫው ውስጥ እንደማይካተት ልብ ሊባል ይገባል ፣ ምክንያቱም ይህ ትኩረት በተግባር ቋሚ ነው። አዎ፣ ምላሽ ለመስጠት
2 CO (g) = CO 2 (g) + C (t)
ሚዛኑ ቋሚ እንደ ተጽፏል
የእኩልነት ቋሚ የሙቀት መጠን (ለሙቀት T 2 ከሙቀት T 1 አንፃር) በሚከተለው የቫንት ሆፍ ቀመር ይገለጻል።
 , (8)
, (8)
የትН 0 - የምላሹ የሙቀት ውጤት።
34. Osmosis, osmotic ግፊት. የቫንት ሆፍ እኩልታ እና የአስሞቲክ ቅንጅት።
ኦስሞሲስ የሟሟ ሞለኪውሎች ድንገተኛ እንቅስቃሴ ከፊል-permeable ሽፋን የተለያየ ትኩረት ያላቸውን መፍትሄዎች የሚለየው ከዝቅተኛ ትኩረትን ወደ ከፍተኛ ትኩረትን ወደ መፍትሄ የሚያመጣ ሲሆን ይህም የኋለኛውን መሟሟትን ያስከትላል። አንድ ሴላፎኒ ፊልም ብዙውን ጊዜ በከፊል-permeable ሽፋን ሆኖ ያገለግላል, ትናንሽ ቀዳዳዎች በኩል ብቻ አነስተኛ መጠን የማሟሟት ሞለኪውሎች እየመረጡ ማለፍ እና ትልቅ ወይም የሚሟሟ ሞለኪውሎች ወይም አየኖች ይቆያል - ከፍተኛ-ሞለኪውላዊ ንጥረ ነገሮች, እና የመዳብ ferrocyanide ፊልም ለ. ለዝቅተኛ ሞለኪውላዊ ንጥረ ነገሮች. የሟሟ ማስተላለፊያ ሂደት (ኦስሞሲስ) ከፍተኛ ትኩረትን ወደ መፍትሄው ውጫዊ ሃይድሮስታቲክ ግፊት ከተተገበረ መከላከል ይቻላል (በሚዛናዊ ሁኔታዎች ይህ በደብዳቤው የተገለፀው ኦስሞቲክ ግፊት ተብሎ የሚጠራው ይሆናል)። ኤሌክትሮላይት ባልሆኑ መፍትሄዎች ውስጥ የ ዋጋን ለማስላት፣ ኢምፔሪካል የቫንት ሆፍ እኩልታ ጥቅም ላይ ይውላል፡-
= ሲ አር ቲ፣
የት C የንብረቱ ሞላላ ክምችት, ሞል / ኪ.ግ;
አር - ሁለንተናዊ የጋዝ ቋሚ, ጄ / ሞል ኬ.
የኦስሞቲክ ግፊት መጠን ከሞለኪውሎች ብዛት ጋር ተመጣጣኝ ነው (በአጠቃላይ ፣ የቁጥሮች ብዛት) አንድ ወይም ከዚያ በላይ ንጥረ ነገሮች በተወሰነ የመፍትሄ መጠን ውስጥ ይሟሟቸዋል ፣ እና በተፈጥሯቸው እና በሟሟ ተፈጥሮ ላይ የተመካ አይደለም። በጠንካራ ወይም ደካማ ኤሌክትሮላይቶች መፍትሄዎች ውስጥ, በሞለኪውሎች መበታተን ምክንያት የነጠላ ቅንጣቶች ጠቅላላ ቁጥር ይጨምራሉ, ስለዚህ, isotonic coefficient ተብሎ የሚጠራው ተመጣጣኝ ተመጣጣኝ መጠን, የኦስሞቲክ ግፊትን ለማስላት ወደ እኩልታው ውስጥ መግባት አለበት.
i ሲ አር ቲ፣
የት እኔ isotonic coefficient ነው, የዚህ ንጥረ ነገር የመጀመሪያ ሞለኪውሎች ብዛት ions እና ያልተከፋፈሉ ኤሌክትሮ ሞለኪውሎች ቁጥሮች ድምር ሬሾ ሆኖ ይሰላል.
ስለዚህ, የኤሌክትሮላይት መበታተን ደረጃ ከሆነ, ማለትም. ወደ ions የተበታተኑ የሞለኪውሎች ብዛት እና የሟሟ ንጥረ ነገር አጠቃላይ የሞለኪውሎች ብዛት ከ ጋር እኩል ነው እና የኤሌክትሮላይት ሞለኪውል ወደ n ionዎች ይፈርሳል ፣ ከዚያ isotonic coefficient በሚከተለው ይሰላል ።
i = 1 + (n - 1) · ፣(i > 1)።
ለጠንካራ ኤሌክትሮላይቶች, = 1, ከዚያም i = n ልንወስድ እንችላለን, እና ኮፊሸን i (ከ 1 በላይ) ደግሞ osmotic coefficient ይባላል.
ከብዙ ንጥረ ነገሮች መፍትሄዎች ጋር በተገናኘ የሴሎቻቸው ሽፋን በከፊል የሚያልፍ ሽፋን ባህሪያት ስላላቸው የኦስሞሲስ ክስተት ለዕፅዋት እና ለእንስሳት ፍጥረታት ትልቅ ጠቀሜታ አለው. በንጹህ ውሃ ውስጥ ሴል በከፍተኛ ሁኔታ ያብጣል, በአንዳንድ ሁኔታዎች ሽፋኑ እስኪሰበር ድረስ, እና ከፍተኛ የጨው ክምችት ባላቸው መፍትሄዎች, በተቃራኒው, በከፍተኛ የውሃ ብክነት ምክንያት መጠኑ እና መጨማደዱ ይቀንሳል. ስለዚህ ምግቦችን በሚቆጥቡበት ጊዜ ከፍተኛ መጠን ያለው ጨው ወይም ስኳር ይጨምራሉ. በእንደዚህ ዓይነት ሁኔታዎች ውስጥ የሚገኙት ረቂቅ ተሕዋስያን ከፍተኛ መጠን ያለው ውሃ ያጣሉ እና ይሞታሉ.
Osmotic ግፊት ተክል ሥሮች ሕዋስ ጭማቂ (5-20 ባር) እና ተጨማሪ በመስኖ ጊዜ ተበርዟል ያለውን የአፈር መፍትሄ መካከል osmotic ግፊት ያለውን ልዩነት ምክንያት ተክሎች ውስጥ የውሃ እንቅስቃሴ ያረጋግጣል. የኦስሞቲክ ግፊት በእጽዋት ውስጥ ውሃ ከሥሩ ወደ ላይ እንዲወጣ ያደርገዋል. ስለዚህ የቅጠል ሴሎች ውሃ በማጣት ከግንድ ሴሎች ውስጥ ኦስሞቲካዊ በሆነ መንገድ ይወስዳሉ, እና የኋለኛው ደግሞ ከስር ሴሎች ይወስዳሉ.
49. የC ions ውህድ የሆነበት የመዳብ-ዚንክ ጋልቫኒክ ሴል ኢኤምኤፍ አስላ።ዩ 2 + ከ 0.001 ሞል / ሊ, እና ions ጋር እኩል ነውዚን 2+ 0.1 ሞል / ሊ. ስሌቶችን በሚሰሩበት ጊዜ መደበኛውን የ EMF ዋጋዎችን ግምት ውስጥ ያስገቡ-
ε o (Zn 2+ /Zn 0) = - 0.74 V እና ε o (Cu 2 + /Cu 0) = + 0.34 V.
የ EMF ዋጋን ለማስላት የኔርንስት እኩልታ ጥቅም ላይ ይውላል 
54. የተበታተኑ ስርዓቶችን የማግኘት ዘዴዎች, ምደባቸው እና አጭር ባህሪያት. ከቴርሞዳይናሚክ እይታ አንጻር የትኛው የተበታተኑ ስርዓቶችን የማግኘት ዘዴ በጣም ጠቃሚ ነው?
የመበታተን ዘዴ. ለተሰጠው መበታተን የጠንካራ ሜካኒካዊ መጨፍጨፍ ያካትታል; በአልትራሳውንድ ንዝረት መበታተን; በተለዋዋጭ እና ቀጥተኛ ጅረት ተጽእኖ ስር የኤሌክትሪክ ስርጭት. በስርጭት ዘዴ የተበታተኑ ስርዓቶችን ለማግኘት, ሜካኒካል መሳሪያዎች በሰፊው ጥቅም ላይ ይውላሉ: ክሬሸር, ወፍጮዎች, ሞርታር, ሮለቶች, ቀለም መፍጫዎች, ሻከርካሪዎች. ፈሳሾች በአቶሚዝድ ተበታትነው የሚረጩት ኖዝል፣ መፍጫ፣ ተሽከርካሪ ዲስኮች እና ሴንትሪፉጅ በመጠቀም ነው። የጋዞች መበታተን በዋነኝነት የሚከናወነው በፈሳሽ አረፋ ውስጥ ነው። በአረፋ ፖሊመሮች፣ በአረፋ ኮንክሪት እና በአረፋ ጂፕሰም ውስጥ ጋዞች የሚመረተው ከፍ ባለ የሙቀት መጠን ወይም በኬሚካላዊ ምላሾች ውስጥ ጋዝ የሚለቁ ንጥረ ነገሮችን በመጠቀም ነው።
የስርጭት ዘዴዎች በስፋት ጥቅም ላይ ቢውሉም, የተበታተኑ ስርዓቶችን -100 nm ጥቃቅን መጠን ለማግኘት ጥቅም ላይ ሊውሉ አይችሉም. እንዲህ ያሉት ስርዓቶች በኮንዳሽን ዘዴዎች የተገኙ ናቸው.
የማጣቀሚያ ዘዴዎች በሞለኪውላር ወይም በአዮኒክ ሁኔታ ውስጥ ከሚገኙ ንጥረ ነገሮች የተበታተነ ደረጃን በመፍጠር ሂደት ላይ የተመሰረቱ ናቸው. ለዚህ ዘዴ አስፈላጊው መስፈርት ከኮሎይድል ስርዓት ማግኘት ያለበት እጅግ የላቀ መፍትሄ መፍጠር ነው. ይህ በተወሰኑ አካላዊ ወይም ኬሚካዊ ሁኔታዎች ውስጥ ሊገኝ ይችላል.
የኮንዳክሽን አካላዊ ዘዴዎች;
1) በአዲያባቲክ መስፋፋት ወቅት የፈሳሽ ወይም የንጥረ ነገሮች ተን ማቀዝቀዝ ወይም ከትልቅ የአየር መጠን ጋር መቀላቀል;
2) ፈሳሹን ከመፍትሔው ውስጥ ቀስ በቀስ ማስወገድ (ትነት) ወይም የተበታተነው ንጥረ ነገር እምብዛም የማይሟሟ በሆነበት ሌላ ፈሳሽ መተካት።
ስለዚህ, አካላዊ ጤዛ በአየር ወለድ ጠጣር ወይም ፈሳሽ ቅንጣቶች, ionዎች ወይም የተሞሉ ሞለኪውሎች (ጭጋግ, ጭጋግ) ላይ ያለውን የውሃ ትነት መጨናነቅን ያመለክታል.
የሟሟ መተካት ወደ መጀመሪያው መፍትሄ ሌላ ፈሳሽ ሲጨመር ሶልት እንዲፈጠር ያደርጋል, ይህም ከመጀመሪያው ፈሳሽ ጋር በደንብ ይቀላቀላል ነገር ግን ለሟሟ ደካማ ፈሳሽ ነው.
የኬሚካል ማቀዝቀዝ ዘዴዎች የተለያዩ ምላሾችን በመፈጸም ላይ የተመሰረቱ ናቸው, በዚህም ምክንያት ያልተሟሟት ንጥረ ነገር ከሱፐርሳቹሬትድ መፍትሄ ይወጣል.
የኬሚካላዊ ብስባሽ ልውውጥ በተለዋዋጭ ግብረመልሶች ላይ ብቻ ሳይሆን በ redox reactions, hydrolysis, ወዘተ ላይ ሊመሰረት ይችላል.
የተበታተኑ ስርዓቶችም በፔፕታይዜሽን ሊገኙ ይችላሉ, እሱም ጥራጣዎችን, ቀድሞውኑ የኮሎይድ መጠኖች ያላቸው ቅንጣቶች ወደ ኮሎይድ "መፍትሄ" መለወጥ. የሚከተሉት የፔፕታይዜሽን ዓይነቶች ተለይተዋል-ፔፕታይዜሽን ዝቃጩን በማጠብ; ከ surfactants ጋር peptization; የኬሚካል peptization.
ለምሳሌ አዲስ የተዘጋጀ እና በፍጥነት የታጠበ የብረት ሃይድሮክሳይድ ትንሽ መጠን ያለው FeCl 3 መፍትሄ (adsorption peptization) ወይም HCl (dissolution) በመጨመር ወደ ቀይ-ቡናማ ኮሎይድል መፍትሄ ይቀየራል።
የፔፕታይዜሽን ዘዴን በመጠቀም የኮሎይድል ቅንጣቶችን የመፍጠር ዘዴ ሙሉ በሙሉ ተጠንቷል-በላይኛው ላይ ያሉ ቅንጣቶች ኬሚካላዊ መስተጋብር በሚከተለው እቅድ መሠረት ይከሰታል ።
ቀጣይ ክፍል ![]() adsorbs Fe +3 ወይም FeO + ions, ተከታዩ የተፈጠሩት በ FeCl 3 ሃይድሮሊሲስ ምክንያት እና ሚሴል ኮር አወንታዊ ክፍያ ይቀበላል. ሚሴል ቀመር እንደሚከተለው ሊፃፍ ይችላል-
adsorbs Fe +3 ወይም FeO + ions, ተከታዩ የተፈጠሩት በ FeCl 3 ሃይድሮሊሲስ ምክንያት እና ሚሴል ኮር አወንታዊ ክፍያ ይቀበላል. ሚሴል ቀመር እንደሚከተለው ሊፃፍ ይችላል-
ከቴርሞዳይናሚክ እይታ አንጻር በጣም ጠቃሚው ዘዴ መበታተን ነው.
1) የአንድ ሉላዊ ቅንጣት ስርጭት መጠን የሚሰላው በአንስታይን እኩልታ በመጠቀም ነው፡-
 ,
,
የት N А የአቮጋድሮ ቁጥር, 6 10 23 ሞለኪውሎች / ሞል;
ሸ - የተበታተነ መካከለኛ መጠን ያለው viscosity, N s / m 2 (Pa s);
r - ቅንጣት ራዲየስ, m;
አር - ሁለንተናዊ የጋዝ ቋሚ, 8.314 J / mol K;
ቲ - ፍጹም ሙቀት, K;
ቁጥር 3.14.
2) ሥር አማካኝ ካሬ መፈናቀል፡-
· ዲ ·
የት የተበታተነ ቅንጣት አማካይ ካሬ መፈናቀል (አማካይ ፈረቃ ዋጋ)፣ m 2 ;
ቅንጣቱ የሚፈናቀልበት ጊዜ (የስርጭት ቆይታ)፣
D የስርጭት መጠን፣ m 2. s -1 .
· D·=2*12.24*10 -10 *5=12.24*10 -9 ሜ 2
መልስ፡- 12.24*10 -9 ሜ 2 .
74. Surfactants. የገጽታ እንቅስቃሴያቸውን የሚገለጡበትን ምክንያቶች እና ዘዴዎች ይግለጹ።
በዝቅተኛ ክምችት ላይ, surfactants እውነተኛ መፍትሄዎችን ይፈጥራሉ, ማለትም. ቅንጣቶች ተበታትነው ወደ ግለሰባዊ ሞለኪውሎች (ወይም ions) ይቀንሳሉ. ትኩረቱ እየጨመረ በሄደ መጠን ሚሴሎች ይታያሉ. በውሃ መፍትሄዎች ውስጥ ፣ በማይሴል ውስጥ የሚገኙት የሞለኪውሎች ኦርጋኒክ ክፍሎች ወደ ፈሳሽ ሃይድሮካርቦን ኮር ፣ እና የዋልታ hydrated ቡድኖች በውሃ ውስጥ ሲሆኑ ፣ የሞለኪውሎቹ ሃይድሮፎቢክ ክፍሎች ከውሃ ጋር የሚገናኙበት አጠቃላይ ስፋት በጣም ጥሩ ነው። ቀንሷል። በማይክል ዙሪያ ባሉ የዋልታ ቡድኖች የውሃ ፍሰት ምክንያት በዋናው የውሃ በይነገጽ ላይ ያለው የገጽታ (በይነገጽ) ውጥረት ከሞለኪውላዊ መፍትሄ እና ከዋና ማክሮፋዝ ጋር ሲነፃፀሩ የእንደዚህ ያሉ ስብስቦች ቴርሞዳይናሚክ መረጋጋትን ወደሚያረጋግጡ እሴቶች ቀንሷል።
በዝቅተኛ የ micellar ውህዶች ፣ ሉላዊ ሚሴልስ (ሃርትሊ ሚሴል) ፈሳሽ አፖላር ኮር ጋር ይመሰረታሉ።
የገጽታ እንቅስቃሴ ከንብረቱ ኬሚካላዊ ቅንብር ጋር የተያያዘ ነው. እንደ ደንቡ ፣ የሱርፋክታንት (የውሃ መፍትሄዎች) እየቀነሰ በመምጣቱ ይጨምራል።
እንደ ላንግሙየር ገለጻ፣ በማስታወቂያ ጊዜ፣ ከዋልታ ክፍል ጋር ከፍተኛ ቅርርብ ያለው የዋልታ ቡድን ወደ ውሃው ውስጥ ይሳባል፣ እና ሃይድሮካርቦን ከዋልታ ያልሆነ ራዲካል ይገፋል። በዚህ ምክንያት የጊብስ ሃይል መቀነስ የወለል ንጣፍን መጠን ወደ አንድ ሞለኪውል ውፍረት ይገድባል። በዚህ ሁኔታ, ሞኖሞሎክላር ሽፋን ተብሎ የሚጠራው ንብርብር ይፈጠራል.
እንደ አወቃቀሩ ላይ በመመስረት, surfactant ሞለኪውሎች ኦርጋኒክ አሲዶች እና መሠረቶች ላይ የተመሠረተ esters, እና ethoxy ቡድኖች ጨምሮ esters, እና ionic መሠረት ላይ የተገነቡ nonionic, ይከፈላሉ.
Ionic surfactants በመፍትሔው ውስጥ ተለያይተው ላዩን-አክቲቭ ionዎችን ይፈጥራሉ፣ ለምሳሌ፡-
ላይ ላዩን ንቁ anions dissociation ወቅት የተቋቋመው ከሆነ, surfactants anionic (የሰባ አሲዶች ጨው, ሳሙናዎች) ይባላሉ. በመበታተን ጊዜ ላይ ላዩን-አክቲቭ cations ከተፈጠሩ, surfactants cationic (የመጀመሪያ ደረጃ, ሁለተኛ ደረጃ እና ሶስተኛ አሚኖች ጨው) ይባላሉ.
እንደ የመፍትሄው ፒኤች ላይ በመመስረት cationic ወይም anoactive (ፕሮቲን፣ አሚኖ አሲዶች) ሊሆኑ የሚችሉ ሰርፋክተሮች አሉ።
የsurfactant ሞለኪውሎች ልዩነታቸው በውሃ ላይ ከፍተኛ የገጽታ እንቅስቃሴ ስላላቸው፣ ይህም የውሃ ላይ የውሃ ንጣፍ መፍትሄ ላይ ያለውን የውጥረት ጥንካሬ የሚያንፀባርቅ ነው።
በዝቅተኛ የስብስብ ክምችት ፣ adsorption ከማጎሪያው ጋር ተመጣጣኝ ነው።
የገጽታ እንቅስቃሴ ከንብረቱ ኬሚካላዊ ቅንብር ጋር የተያያዘ ነው. እንደ ደንቡ ፣ የሱርፋክታንት (የውሃ መፍትሄዎች) እየቀነሰ በመምጣቱ ይጨምራል። ለምሳሌ, ለካርቦቢሊክ አሲዶች የእንቅስቃሴ ዋጋ ከጨውዎቻቸው የበለጠ ነው.
የግብረ-ሰዶማውያን ተከታታይ ጥናቶችን በሚያጠናበት ጊዜ በሃይድሮካርቦን ራዲካል ርዝመት ላይ ግልጽ የሆነ የእንቅስቃሴ ጥገኛ ተገኝቷል.
በ 19 ኛው ክፍለ ዘመን መገባደጃ ላይ ከፍተኛ መጠን ባለው የሙከራ ቁሳቁስ ላይ በመመስረት ዱክሎስ እና ትራውብ ደንብ ቀርበዋል-በአንድ የ CH 2 ቡድን ውስጥ የሃይድሮካርቦን ሰንሰለት በመጨመር በተከታታይ ግብረ-ሰዶማዊነት ውስጥ የወለል እንቅስቃሴ ከ3-3.5 ጊዜ ይጨምራል።
ትኩረቱ እየጨመረ በሄደ መጠን በፈሳሹ ላይ ያለው ንክኪ በመጀመሪያ በከፍተኛ ሁኔታ ይጨምራል ከዚያም ወደ የተወሰነ ገደብ ይጠጋል፣ ይህም ገደብ አድሶርፕሽን ይባላል።
በዚህ እውነታ እና በብዙ ጥናቶች ላይ በመመስረት ላንግሙየር በገፀ-ንብርብሩ ውስጥ የሞለኪውሎች አቅጣጫን ሀሳብ አቅርቧል። Langmuir መሠረት, adsorption ወቅት, አንድ የዋልታ ቡድን, የዋልታ ዙር ለ ከፍተኛ ዝምድና ያለው - ውሃ, ወደ ውኃ ውስጥ ይሳባሉ, እና ሃይድሮካርቦን ያልሆኑ የዋልታ አክራሪ ወደ ውጭ ይገፋሉ ነው. በዚህ ምክንያት የጊብስ ሃይል መቀነስ የወለል ንብርብሩን መጠን ወደ አንድ ሞለኪውል ውፍረት ይገድባል። በዚህ ሁኔታ, ሞኖሞሎክላር ሽፋን ተብሎ የሚጠራው ንብርብር ይፈጠራል.
በውሃ ወለል ላይ ያሉ ሞኖሞሊኩላር ፊልሞች በሶስት ግዛቶች ሊኖሩ ይችላሉ-ጋዝ ፣ ፈሳሽ እና ጠንካራ። ፈሳሽ እና ጠንካራ የገጽታ ፊልሞች ኮንደንስ ፊልም ይባላሉ።
በፊልሙ ውስጥ ባሉ ሞለኪውሎች መካከል የሚሠሩት ኃይሎች በአንጻራዊ ሁኔታ ትንሽ ከሆኑ ፣ የሱሪክታንት ሞለኪውሎች በውሃው ላይ በነፃነት ይሰራጫሉ ፣ በተቻለ መጠን እርስ በእርስ ይርቃሉ ፣ ይህም ከወለል ጋር በተቃራኒ አቅጣጫ የሚሠራውን የወለል ግፊት ይወስናል ። ውጥረት, እንዲህ ዓይነቱ ፊልም እንደ ሁለት አቅጣጫዊ ጋዝ ተደርጎ ሊወሰድ ይችላል, ምክንያቱም ሞለኪውሎች ይህ ጋዝ ከውኃው ወለል ሊሰበር ስለማይችል እና በሁለት ልኬቶች ብቻ ሊንቀሳቀስ ይችላል. በውሃ ላይ ባለ ሁለት ገጽታ የጋዝ ፊልሞችን የሚፈጥሩ ንጥረ ነገሮች ለምሳሌ ከ 12 እስከ 20-22 የሃይድሮካርቦን አቶሞች ብዛት ያላቸው ቅባት አሲዶች ፣ አልፋቲክ አልኮሎች እና አሚኖች በጣም ከፍተኛ የሞለኪውል ክብደት የላቸውም።
ላይ ላዩን ፊልም ውስጥ surfactant ሞለኪውሎች ሃይድሮካርቦን radicals መካከል tangential ኃይሎች ትልቅ ከሆነ, ከዚያም ሞለኪውሎች አንድ ላይ ተጣብቀው, ትልቅ የታመቀ "ደሴቶች" በመፍጠር ውስጥ ሞለኪውሎች ያለውን የሙቀት እንቅስቃሴ እንቅፋት ነው. በእንደዚህ ዓይነት "ደሴቶች" ውስጥ ሞለኪውሎቹ ብዙውን ጊዜ እርስ በርስ ትይዩ እና ከውሃው ወለል ጋር ተመሳሳይ ናቸው. ሆኖም ግን, ለምሳሌ, እየጨመረ በሚሄድ የሙቀት መጠን, የተጨመቁ ፊልሞች ወደ ጋዝ ሊለወጡ እንደሚችሉ ልብ ሊባል ይገባል.
የተጨመቁ ፊልሞች ብዙውን ጊዜ ፈሳሽ ናቸው, እና በውስጣቸው ያሉት ሞለኪውሎች በነፃነት ይንቀሳቀሳሉ. በራዲካል መካከል ያለው መስተጋብር ሃይሎች በጣም ጠንካራ ከሆኑ ሞለኪውሎቹ መንቀሳቀስ የማይችሉ ከሆነ፣ የተጨመቁት ፊልሞች እንደ ጠንካራ ሊቆጠሩ ይችላሉ። እንደነዚህ ያሉት ፊልሞች ከ 20-24 የሚበልጡ የካርቦን አቶሞች ብዛት ያላቸው ካርቦቢሊክ አሲዶችን ይፈጥራሉ።
በገጸ-ገጽታ ፊልሞች ውስጥ ጠንካራ-ግዛት ባህሪያት መኖራቸውን መሬት ላይ ዱቄት በመርጨት ሊረጋገጥ ይችላል። ፊልሙ ጠንካራ ከሆነ በጥንቃቄ ከተነፈሰ ዱቄቱ እንቅስቃሴ አልባ ሆኖ ይቆያል፤ ፊልሙ ፈሳሽ ከሆነ ዱቄቱ በላዩ ላይ ይንቀሳቀሳል።
ከጋዝ እና ከተጨመቁ ፊልሞች በተጨማሪ መካከለኛ ቦታን የሚይዙ የተዘረጉ ፊልሞች የሚባሉት መኖራቸውን ልብ ሊባል ይገባል.
እንደነዚህ ያሉት ፊልሞች የሙቀት መጠኑ እየጨመረ ከኮንደንስ ሊፈጠሩ ይችላሉ. በተዘረጉ ፊልሞች ውስጥ የሃይድሮካርቦን ራዲካል ሞለኪውሎች በትይዩ ላይ ያተኮሩ አይደሉም ፣ ግን እርስ በእርሳቸው የተሳሰሩ ናቸው ፣ በውሃ ላይ “ጠፍጣፋ” ተኝተዋል ፣ ይህም ፊልሙ ያልተገደበ ስርጭትን ይከላከላል ፣ የዋልታ ቡድኖች በአንፃራዊነት በነፃነት ይንቀሳቀሳሉ ። የላይኛው ንጣፍ.
ለ ion surfactants የተወሰኑ ፊልሞችን የመፍጠር ንጥረ ነገሮች ችሎታ በመፍትሔው ፒኤች ላይ የተመሠረተ ነው። ከፍ ያለ የሰባ አሲዶች በአሲድ እና ገለልተኛ መፍትሄዎች (ማለትም ፣ በተግባር ባልተከፋፈሉ ቡድኖች) በተወሰነ የሙቀት መጠን ከአየር ጋር በሚገናኙበት ጊዜ የተዘረጉ ፊልሞችን ይሰጣሉ ። በአልካላይን አካባቢ ውስጥ በተመሳሳይ የሙቀት መጠን, የመፍትሄው ገጽ ላይ የጋዝ ፊልሞች ይፈጠራሉ, ይህም በመለያያቸው ምክንያት የታዩትን የአጎራባች ቡድኖች መሰል ክሶች ውድቅ በማድረግ ነው.
89. በተጠቆሙት ንጥረ ነገሮች መስተጋብር ምክንያት የተፈጠረውን የሶል ሚሴል አወቃቀር ቀመር ይፃፉ (ከአንድ በላይ ፣ ከዚያ ሌላ ንጥረ ነገር)። ሲዲሲ.ኤል 2 + ና 2 ኤስ; FeCl 3 + ናኦህ. የአንድ ማይክል አካል ክፍሎችን ይሰይሙ።
1) ሲዲሲኤል 2 + ና 2 ኤስ
ከመጠን በላይ ሲዲሲኤል 2 ሚሴል ይሰጣል፡-
[(ሲዲሲኤል 2) ሲዲ 2+ ክሎ -] + x Cl -
ጀርም: (ሲዲሲኤል 2)
አንኳር፡ [(ሲዲሲኤል 2) ሲዲ 2+
granule: [ (ሲዲሲኤል 2) ሲዲ 2+ ክሎ -] +
ትርፍ ና 2 S ሚሴል ይሰጣል፡-
- xNa+
ጀርም: (NaCl)
አንኳር፡ (NaCl)2Cl -
granule: [ (ሲዲሲኤል 2) ሲዲ 2+ ክሎ -] +
2) FeCl 3 + NaOH
ከ FeCl 3 በላይ መጨመር ሚሴል ይሰጣል፡-
[(FeCl 3) Fe 3+ 2Cl –] + x Cl –
ጀርም: (FeCl 3)
አንኳር፡ (FeCl 3) Fe 3+
granule: [(FeCl 3) Fe 3+ 2Cl -] +
ከመጠን በላይ ናኦኤች ሚሴል ይሰጣል፡-
- xNa+
ጀርም: (NaCl)
አንኳር፡ 3 (NaCl) 3 Cl –
ጥራጥሬ: -
94. IUD በመጠቀም የኮሎይድ ቅንጣቶችን መከላከል. የመከላከያ እርምጃ ዘዴ. ፕሮቲኖች, ካርቦሃይድሬቶች, pectins እንደ ኮሎይድል መከላከያ.
የኮሎይድ መከላከያ - በተበታተነው ደረጃ ቅንጣቶች ዙሪያ የማስታወቂያ መከላከያ ዛጎል በመፍጠር የተበታተነ ስርዓትን ማረጋጋት. ፕሮቲኖች ፣ pectin እና ካርቦሃይድሬትስ የተበታተኑ ስርዓቶችን እንደ ማረጋጊያ ሆነው ያገለግላሉ ፣ ስርዓቶችን ከተጨማሪ የደም መርጋት ወይም መበታተን ይከላከላሉ ።
110. አረፋዎች, የተፈጠሩበት ሁኔታ እና ባህሪያቸው. ለምግብነት የአረፋነት ሚና እና የአረፋ አጠቃቀም ምሳሌዎች.
Foams በጣም የተከማቸ የተበታተኑ ስርዓቶች (የጋዝ መጠን ከ 60-80% በላይ) ናቸው, በውስጡም የተበታተነው ደረጃ ጋዝ ነው, እና የተበታተነው መካከለኛ ፈሳሽ ወይም ጠንካራ (የአረፋ ኮንክሪት, የአረፋ ጂፕሰም, የአረፋ ፖሊመሮች, ወዘተ) ነው. አረፋዎች ከ 0.01 ሴ.ሜ እስከ 0.1 ሴ.ሜ ወይም ከዚያ በላይ የሆኑ የአረፋዎች መጠን ያላቸው ጥቃቅን ስርዓቶች ናቸው. በጣም ብዙ ጊዜ, ፈሳሽ ስርጭት መካከለኛ ጋር አረፋዎች ማረጋጊያ ፊት ፈሳሽ ውስጥ ጋዝ በመበተን ማግኘት, በዚህ ሁኔታ ውስጥ አረፋ ወኪል ይባላል.
አረፋ የሆኑ የምግብ ምርቶች እንደ ፊኛዎች ያሉ አረፋዎችን ያካትታሉ ። የወተት ሻካራዎች እንዲሁ በመገረፍ ይዘጋጃሉ እና በመጀመሪያ ክፍሎቹ አረፋ ይፈጥራሉ። በምግብ ኢንዱስትሪ ውስጥ በአረፋ በመታገዝ ጠቃሚ የሆኑ ቆሻሻዎችን ከመፍትሔዎች ያስወጣሉ, በተለይም በደረቁ አረፋዎች ውስጥ ውጤታማ ናቸው. ነገር ግን በስኳር ምርት ውስጥ አረፋ በተለመደው የአሠራር ሂደት ውስጥ ጣልቃ ይገባል እናም በዚህ ሁኔታ አረፋን ማስወገድ ይከናወናል.
ስነ ጽሑፍ
Akhmetov B.V. በአካላዊ እና ኮሎይድል ኬሚስትሪ ውስጥ ችግሮች እና ልምምዶች. - ኤል.: ኬሚስትሪ, 1989.
Gameeva O.S. አካላዊ እና ኮሎይድል ኬሚስትሪ. - ኤም.: ሁለተኛ ደረጃ ትምህርት ቤት, 1983.
Evstratova K.I., Kupina N.A., Malakhova E.M. አካላዊ እና ኮሎይድል ኬሚስትሪ. - ኤም.: ሁለተኛ ደረጃ ትምህርት ቤት, 1990.
ዚሞን ኤ.ዲ., ሌሽቼንኮ ኤን.ኤፍ. ኮሎይድ ኬሚስትሪ. - ኤም.: ኬሚስትሪ, 2001.
ዚሞን ኤ.ዲ., ሌሽቼንኮ ኤን.ኤፍ. ፊዚካል ኬሚስትሪ. - ኤም.: ኬሚስትሪ, 2000.
Kiselev E.V. በአካላዊ ኬሚስትሪ ውስጥ ምሳሌዎች እና ችግሮች ስብስብ. - ኤም.: ሁለተኛ ደረጃ ትምህርት ቤት, 1983.
Knorre D.G. ፊዚካል ኬሚስትሪ. - ኤም.: ሁለተኛ ደረጃ ትምህርት ቤት, 1990.
Stromberg A.G. ፊዚካል ኬሚስትሪ. - ኤም.: ሁለተኛ ደረጃ ትምህርት ቤት, 2001.
ስቴፒን ቢ ዲ በኬሚስትሪ ውስጥ የአካላዊ መጠን አሃዶች ዓለም አቀፍ ስርዓቶች። - ኤም.: ሁለተኛ ደረጃ ትምህርት ቤት, 1990.
ፍሬድሪችስበርግ ዲ.ኤ. የኮሎይድ ኬሚስትሪ ኮርስ። - ኤል.: ኬሚስትሪ, 1995.
Khmelnitsky R.A. አካላዊ እና ኮሎይድል ኬሚስትሪ. - ኤም.: ሁለተኛ ደረጃ ትምህርት ቤት, 1988.
ዲስፕሊን ለማግኘት ሁለት አጠቃላይ መንገዶች አሉ። ስርዓቶች - መበታተን እና ማቀዝቀዝ. የስርጭት ዘዴው የማክሮስኮፒክ ቅንጣቶችን ወደ ናኖዚዝስ (1-100 nm) መፍጨት ላይ የተመሠረተ ነው።
በከፍተኛ የኃይል ፍጆታ ምክንያት ሜካኒካል መፍጨት በስፋት ጥቅም ላይ አይውልም. በቤተ ሙከራ ልምምድ ውስጥ, አልትራሳውንድ መፍጨት ጥቅም ላይ ይውላል. በመፍጨት ጊዜ ሁለት ሂደቶች ይወዳደራሉ-የተበታተኑ እና የተገኙትን ቅንጣቶች ማሰባሰብ. የእነዚህ ሂደቶች ሬሾ የሚወሰነው በመፍጨት ጊዜ ፣ በሙቀት ፣ በፈሳሽ ደረጃው ተፈጥሮ እና በ stabilizers (በአብዛኛው surfactants) መኖር ላይ ነው። ተስማሚ ሁኔታዎችን በመምረጥ አስፈላጊውን መጠን ያላቸውን ቅንጣቶች ማግኘት ይቻላል, ነገር ግን የንጥሉ መጠን ስርጭት በጣም ሰፊ ሊሆን ይችላል.
በጣም የሚያስደስት በፈሳሽ ጊዜ ውስጥ ጠንካራ አካላት ድንገተኛ መበታተን ነው። በተነባበረ መዋቅር ላላቸው ንጥረ ነገሮች ተመሳሳይ ሂደት ሊታይ ይችላል. በእንደዚህ አይነት አወቃቀሮች ውስጥ በንብርብሩ ውስጥ ባሉ አተሞች እና በንብርብሮች መካከል ያለው ደካማ የ v-d-v ግንኙነት መካከል ጠንካራ መስተጋብር አለ። ለምሳሌ ሞሊብዲነም እና ቱንግስተን ሰልፋይዶች ተደራራቢ መዋቅር ያላቸው በድንገት በአቴቶኒትሪል ውስጥ ተበታትነው ናኖሜትር የሚያክሉ ባለቢየር ቅንጣቶችን ይፈጥራሉ። በዚህ ሁኔታ የፈሳሽ ደረጃው በንብርብሮች መካከል ዘልቆ ይገባል, የ interlayer ርቀትን ይጨምራል, እና በንብርብሮች መካከል ያለው ግንኙነት ይዳከማል. በሙቀት ንዝረቶች ተጽእኖ ስር, ናኖፓርቲሎች ከቲቪው ክፍል ወለል ላይ ይገለላሉ.
የማቀዝቀዝ ዘዴዎችበአካላዊ እና በኬሚካል የተከፋፈሉ ናቸው. የ nanoparticles ምስረታ የሚከሰተው መካከለኛ ስብስቦች በሚፈጠሩበት ጊዜ በተከታታይ የሽግግር ግዛቶች ውስጥ ነው ፣ ይህም ወደ አዲስ ምዕራፍ ኒውክሊየስ መምጣት ፣ ድንገተኛ እድገቱ እና የአካላዊ ደረጃ በይነገጽ ገጽታ ያስከትላል። ከፍተኛ መጠን ያለው የፅንስ መፈጠር እና ዝቅተኛ የእድገት መጠን ማረጋገጥ አስፈላጊ ነው.
አልትራዲስፔስ ብረቶች ለማግኘት አካላዊ ዘዴዎች በሰፊው ጥቅም ላይ ይውላሉ. እነዚህ ዘዴዎች በመሠረቱ መበታተን-ኮንደንስሽን ዘዴዎች ናቸው. በመጀመሪያ ደረጃ, ብረቱ በእንፋሎት ወደ አቶሞች ይሰራጫል. ከዚያም በእንፋሎት ከመጠን በላይ በመሙላት ምክንያት ኮንደንስ ይከሰታል.
የሞለኪውል ጨረር ዘዴወደ 10 nm ውፍረት ያለው ሽፋን ለማምረት ያገለግላል. ዲያፍራም ባለው ክፍል ውስጥ ያለው የምግብ ቁሳቁስ በቫኩም ውስጥ ወደ ከፍተኛ ሙቀት ይሞቃል. በዲያፍራም በኩል የሚያልፉት የተተነኑ ቅንጣቶች ሞለኪውላዊ ጨረር ይፈጥራሉ. የጨረራ ጥንካሬ እና በንጥረቶቹ ላይ ያለው የንፅፅር መጠን ከምንጩ ቁሳቁስ በላይ ያለውን የሙቀት መጠን እና የእንፋሎት ግፊት በመቀየር ሊለወጥ ይችላል።
ኤሮሶል ዘዴበዝቅተኛ የሙቀት መጠን ውስጥ የብረታ ብረት ትነት በዝቅተኛ የአየር ሙቀት ውስጥ በከባቢ አየር ውስጥ የማይነቃነቅ ጋዝ እና የእንፋሎት ውሀን ይከተላል። ይህንን ዘዴ በመጠቀም የ Au, Fe, Co, Ni, Ag, Al nanoparticles ተገኝተዋል; የእነሱ ኦክሳይድ, ናይትሬድ, ሰልፋይዶች.
ክሪዮኬሚካል ውህደትበዝቅተኛ የሙቀት መጠን ውስጥ የብረት አተሞች (ወይም የብረት ውህዶች) በማይንቀሳቀስ ማትሪክስ ውስጥ ባለው ኮንደንስ ላይ የተመሰረተ ነው.
የኬሚካል ኮንዲሽን. በ 1857 በፋራዴይ በ 1857 የወርቅ (ቀይ) የኮሎይድ መፍትሄ የተገኘው ከቅንጣት መጠን ጋር ነው. ይህ ሶል በብሪቲሽ ሙዚየም ውስጥ ይታያል. የእሱ መረጋጋት በጠንካራ ደረጃ-መፍትሄ በይነገጽ ላይ በኤዲኤል ምስረታ እና በኤሌክትሮስታቲክ የመለጠጥ ግፊት አካል መልክ ይገለጻል።
ብዙውን ጊዜ የኬሚካላዊ ምላሾች በሚፈጠሩበት ጊዜ የናኖፓርተሎች ውህደት በመፍትሔ ውስጥ ይከናወናል. የመቀነስ ምላሾች የብረት ብናኞችን ለማምረት ያገለግላሉ. አልሙኒየም እና ቦሮሃይድሬድ፣ ሃይፖፎስፋይት ወዘተ የመሳሰሉትን ለመቀነሻነት ያገለግላሉ።ለምሳሌ 7 nm የሆነ ቅንጣት ያለው የወርቅ ሶል የሚገኘው በሶዲየም ቦሮሃይድራይድ የወርቅ ክሎራይድ በመቀነስ ነው።
የብረታ ብረት ጨዎችን ወይም ኦክሳይድ ናኖፓርተሎች የሚገኘው በመለዋወጥ ወይም በሃይድሮሊሲስ ግብረመልሶች ነው።
እንደ ማረጋጊያ የተፈጥሮ እና ሰው ሰራሽ ተውሳኮች ጥቅም ላይ ይውላሉ.
የተደባለቀ ስብጥር ናኖፓርተሎች ተቀላቅለዋል. ለምሳሌ፣ ሲዲ/ዜንኤስ፣ ዚንኤስ/ሲዲሴ፣ ቲኦ 2/ሲኦ 2። እንደነዚህ ያሉት ናኖፓርቲሎች የሚገኙት በአንድ ዓይነት (ሼል) ሞለኪውሎች ቀደም ሲል በተቀነባበረ የሌላ ዓይነት (ኮር) ናኖፓርቲክል ላይ በማስቀመጥ ነው።
የሁሉም ዘዴዎች ዋነኛው ኪሳራ የ nanoparticles ሰፊ መጠን ስርጭት ነው. የ nanoparticles መጠንን ለመቆጣጠር ከሚረዱ ዘዴዎች ውስጥ አንዱ በተቃራኒው ማይክሮኢሚልሽን ውስጥ ናኖፖታቲከሎች ከመፍጠር ጋር የተያያዘ ነው. በተገላቢጦሽ ማይክሮ ኢሚልሽንስ፣ የዲስ ፋሽኑ ውሃ ሲሆን መካከለኛው ደግሞ ዘይት ነው። የውሃ ጠብታዎች መጠን (ወይም ሌላ የዋልታ ፈሳሽ) እንደ የምርት ሁኔታ እና እንደ ማረጋጊያው ባህሪ ላይ በመመርኮዝ በሰፊው ሊለያይ ይችላል። የውሃ ጠብታ አዲስ ምዕራፍ የሚፈጠርበት የሬአክተር ሚና ይጫወታል። የውጤቱ ቅንጣት መጠን በጥልቀቱ መጠን የተገደበ ነው፡ የዚህ ቅንጣቢ ቅርጽ የተንጠባጠበውን ቅርጽ ይከተላል።
የሶል-ጄል ዘዴየሚከተሉትን ደረጃዎች ይዟል: 1. የመነሻ መፍትሄ ማዘጋጀት, ብዙውን ጊዜ የብረት አልክሳይድ M (OR) n, M ሲሊከን, ቲታኒየም, ዚንክ, አልሙኒየም, ቆርቆሮ, ሴሪየም, ወዘተ, R አልካል ወይም aryl; 2. በፖሊሜራይዜሽን ምላሾች ምክንያት ጄል መፈጠር; 3. ማድረቅ; 4. የሙቀት ሕክምና. ሃይድሮሊሲስ በኦርጋኒክ ፈሳሾች ውስጥ ይካሄዳል
M(OR) 4 +4H 2 OM(OH) 4 +4ROH።
ከዚያም ፖሊሜራይዜሽን እና ጄል መፈጠር ይከሰታል
mM(OH) n (MO) 2 +2mH 2 O.
Peptization ዘዴ.ደለል ሲታጠብ peptization አሉ, አንድ ኤሌክትሮ ጋር ደለል peptization; ከ surfactants ጋር peptization; የኬሚካል peptization.
ደለል በሚታጠብበት ጊዜ ፔፕታይዜሽን የደም መርጋትን ከሚያመጣው ደለል ውስጥ ኤሌክትሮላይትን ለማስወገድ ይቀንሳል. በዚህ ሁኔታ የ EDL ውፍረት ይጨምራል, የ ion-electrostatic repulsion ኃይሎች በ intermolecular መስህብ ኃይሎች ላይ ይሸነፋሉ.
ከኤሌክትሮላይት ጋር ያለው ደለል (ፔፕታይዜሽን) ከኤሌክትሮላይት አየኖች ውስጥ አንዱ በንጣፎች ላይ እንዲጣበቁ ከሚያደርጉት ችሎታ ጋር የተቆራኘ ነው, ይህም በንጥረቶቹ ላይ የ DES መፈጠርን ያበረታታል.
ከሰርፊኬተሮች ጋር ፔፕታይዜሽን. Surfactant macromolecules, ቅንጣቶች ላይ adsorbed, ወይ ክፍያ (ionogenic surfactants) መስጠት ወይም ቅንጣቶች ደለል ውስጥ አብረው መጣበቅ የሚያግድ adsorption-መፍትሄ ማገጃ ይፈጥራሉ.
በሲስተሙ ውስጥ የተጨመረው ንጥረ ነገር በዝናብ ውስጥ ካለው ንጥረ ነገር ጋር ምላሽ ሲሰጥ የኬሚካል ፔፕታይዜሽን ይከሰታል. በዚህ ሁኔታ, ኤሌክትሮላይት (ኤሌክትሮላይት) ይፈጠራል, ይህም በንጣፎች ላይ DES ይፈጥራል.
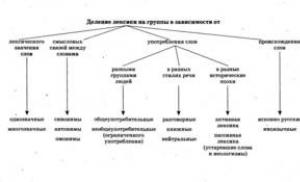
የተበታተኑ ስርዓቶችን ለማግኘት ዘዴዎች
የኮሎይድ መፍትሄዎችን ለማግኘት የሚረዱ ዘዴዎች በሁለት ቡድን ሊከፈሉ ይችላሉ-የኮንደንስ እና የመበታተን ዘዴዎች (በኋላ ላይ የሚብራራ የፔፕታይዜሽን ዘዴ የተለየ ቡድን ነው). የሶልሶችን ለማግኘት ሌላው አስፈላጊ ሁኔታ የንጥረቱን መጠን ወደ ኮሎይድ ከማምጣት በተጨማሪ በማረጋጊያዎች ስርዓት ውስጥ መገኘት - የኮሎይድ ቅንጣቶችን ድንገተኛ መጨመርን የሚከላከሉ ንጥረ ነገሮች.
ሩዝ. የተበታተኑ ስርዓቶችን ለማምረት ዘዴዎች ምደባ
(የስርዓቶች ዓይነት በቅንፍ ውስጥ ይገለጻል)
የመበታተን ዘዴዎች
የስርጭት ዘዴዎች ጠጣርን ወደ ኮሎይድ መጠን ያላቸው ቅንጣቶች በመጨፍለቅ እና በዚህም የኮሎይድ መፍትሄዎችን በመፍጠር ላይ የተመሰረቱ ናቸው. የስርጭት ሂደቱ በተለያዩ ዘዴዎች ይከናወናል-በሚጠራው ውስጥ ያለውን ንጥረ ነገር ሜካኒካዊ መፍጨት. የኮሎይድ ወፍጮዎች, የኤሌክትሪክ ቅስት ብረቶች በመርጨት, አልትራሳውንድ በመጠቀም ንጥረ ነገሮችን መጨፍለቅ.
መበታተን ድንገተኛ እና ድንገተኛ ያልሆነ መሆን አለበት. ድንገተኛ ስርጭት የ lyophilic ስርዓቶች ባህሪይ እና ከስርአቱ መዛባት መጨመር ጋር የተያያዘ ነው (ከአንድ ትልቅ ቁራጭ ብዙ ትናንሽ ቅንጣቶች ሲፈጠሩ). በቋሚ የሙቀት መጠን ሲሰራጭ የኢንትሮፒ መጨመር ከ enthalpy ለውጥ መብለጥ አለበት።
የሊዮፎቢክ ስርዓቶችን በተመለከተ ፣ ድንገተኛ ስርጭት አይካተትም ፣ ስለሆነም መበታተን የሚቻለው የተወሰነ መጠን ያለው ሥራ ወይም ተመጣጣኝ የሙቀት መጠን በማውጣት ብቻ ነው ፣ በተለይም በ enthalpy ይለካል።
በ isobaric-isothermal ሂደት ውስጥ የ enthalpy ለውጥ የሚወሰነው በመገጣጠም ስራ W k እና በማጣበቅ ስራ መካከል ባለው ግንኙነት መካከል ባለው ግንኙነት ነው. የመገጣጠም ኃይል (ሥራ) በሰውነት ውስጥ ያለውን ግንኙነት ያሳያል, እና የማጣበቂያው ኃይል (ሥራ) ከአካባቢው ጋር ያለውን ግንኙነት ያሳያል.
አዲስ ወለል ምስረታ ኃይል ቅጽ ያለው enthalpy, አንፃር ሊገለጽ ይችላል
እኩልታው በመበታተን ምክንያት የሚመጣውን የ enthalpy ለውጥ ያሳያል። በድንገተኛ መበታተን ለሚችሉ የላይፊሊክ ስርዓቶች, ΔS> 0 ሲከሰት, ΔH ከሚለው ሁኔታ ይከተላል.< 0 и
የዚህ ሁኔታ መሟላት ማለት አንድ ትልቅ ቁራጭ ወደ ብዙ ትናንሽ ድንገተኛ መበታተን ማለት ነው. እንደ IUD መፍትሄዎች, የሸክላ ቅንጣቶች እና አንዳንድ ሌሎች ለመሳሰሉት የሊዮፊል ስርዓቶች ተመሳሳይ ሂደት ይታያል.
ከ lyophilic ስርዓቶች በተቃራኒ በሊዮፎቢክ ስርዓቶች ውስጥ ያለው ውህደት W የኢንተርፋስ መስተጋብር ኃይልን ይጨምራል, ᴛ.ᴇ. adhesion W a. የ enthalpy (ΔH> 0) መጨመር ከጊብስ ሃይል መጨመር ጋር ይዛመዳል
ΔH > TΔS; ΔG > 0.
በዚህ ሁኔታ ውስጥ ያለው ስርጭት ሂደት በተለምዶ ድንገተኛ ያልሆነ እና በውጫዊ ጉልበት ምክንያት ይከናወናል.
መበታተን በተበታተነው ደረጃ ተለይቶ ይታወቃል. በመነሻው ምርት መጠኖች ሬሾ እና በተፈጠረው ስርዓት ውስጥ በተበታተነው ክፍል ቅንጣቶች ይወሰናል. የተበታተነው ደረጃ እንደሚከተለው ሊገለፅ ይችላል-
α 1 = d n / d k; α 2 = B n / B k; α 3 = V n/V ኪ፣
የት d n; መ ወደ; Bn; ለ; ቪ n; Vk - በቅደም ተከተል ዲያሜትር, የወለል ስፋት, ከመበታተን በፊት እና በኋላ የንጥሎች መጠን.
ነገር ግን፣ የተበታተነው ደረጃ በመጠን (α 1)፣ በገጽታ አካባቢ (α 2) ወይም በድምጽ (α 3) በተበታተነው ደረጃ ቅንጣቶች ክፍሎች፣ ᴛ.ᴇ መገለጽ አለበት። መስመራዊ፣ ላዩን ወይም ቮልሜትሪክ መሆን አለበት።
ድፍን ወይም ፈሳሽን ለመበተን የሚያስፈልገው ስራ W d አካልን ለመጉዳት እና አዲስ የክፍል በይነገጽ W a በመፍጠር ላይ ይውላል, ይህም የሚለካው በማጣበቅ ስራ ነው. የሰውነት መበላሸት አካልን ለማጥፋት እጅግ በጣም አስፈላጊ ቅድመ ሁኔታ ነው. እንደ P.A. Rebinder, የተበታተነው ሥራ በቀመርው ይወሰናል
ወ = ዋ + ዋ ዲ = σ * ΔB + ኪ.ቮ፣
σ * በተበታተነው ደረጃ እና በተበታተነው መካከለኛ መካከል ባለው በይነገጽ ላይ ካለው የወለል ውጥረት ጋር ተመጣጣኝ ወይም እኩል የሆነ እሴት ሲሆን; ΔB - በመበታተን ምክንያት የደረጃ በይነገጽ መጨመር; V ከመበተኑ በፊት የዋናው አካል መጠን ነው; k በአንድ የሰውነት ክፍል ውስጥ ካለው የመበስበስ ሥራ ጋር እኩል የሆነ ኮፊሸን ነው።
የማቀዝቀዝ ዘዴዎች
የተበታተኑ ስርዓቶችን ለማምረት የአየር ማቀዝቀዣ ዘዴዎች ኮንደንስ, መበስበስ እና ክሪስታላይዜሽን ያካትታሉ. Οʜᴎ በጋዝ ወይም በፈሳሽ መካከለኛ ውስጥ ባለው ንጥረ ነገር ልዕለ-ሳቹሬትድ ሁኔታ ስር አዲስ ምዕራፍ ምስረታ ላይ የተመሰረቱ ናቸው። በዚህ ሁኔታ, ስርዓቱ ከተመሳሳይ ወደ ሄትሮጂንስ ይሄዳል. ኮንደንስ እና መበስበስ የጋዝ መሃከለኛ ባህሪያት ናቸው, እና ክሪስታላይዜሽን የፈሳሽ መካከለኛ ባህሪይ ነው.
ለጤና እና ክሪስታላይዜሽን አስፈላጊው ሁኔታ በተበታተነው መካከለኛ (የማጎሪያ መለዋወጥ) ውስጥ ያለው ንጥረ ነገር ከመጠን በላይ መጨናነቅ እና ያልተስተካከለ ስርጭት ፣ እንዲሁም የ condensation ማዕከሎች ወይም ኒውክሊየስ መፈጠር ነው።
ለመፍትሔ እና ለእንፋሎት የሱፐርሰቱሬሽን β ደረጃ እንደሚከተለው ሊገለፅ ይችላል-
β f = ሰ/ሰ ፣ β P = r/p s ፣
የት p, c የሱፐርሳቹሬትድ የእንፋሎት ግፊት እና በሱፐርሰቱሬትድ መፍትሄ ውስጥ ያለው ንጥረ ነገር ክምችት; p s በጠፍጣፋ መሬት ላይ ያለው የሳቹሬትድ ትነት ተመጣጣኝ ግፊት; c s ከአዲስ ምዕራፍ ምስረታ ጋር የሚዛመድ ሚዛናዊ ትኩረት ነው።
ክሪስታላይዜሽን ለማካሄድ, መፍትሄው ወይም የጋዝ ቅልቅል ይቀዘቅዛል.
የተበታተኑ ስርዓቶችን ለማግኘት በእርጥበት ዘዴዎች ስር የጊብስ ኢነርጂ (ΔG) በመቀነሱ ምክንያት የሚከሰቱ ክሪስታላይዜሽን ፣ የመበስበስ እና የማቀዝቀዝ ሂደቶች ናቸው ።< 0) и протекают самопроизвольно.
ከሱፐርሳቹሬትድ መፍትሄ ወይም ከጋዝ መካከለኛ ክፍልፋዮች ኑክሌር እና ምስረታ ወቅት ኬሚካላዊው እምቅ ለውጥ µ አንድ በይነገጽ ይታያል፣ ይህም ከመጠን በላይ ነፃ የሆነ የገጽታ ሃይል ተሸካሚ ይሆናል።
ቅንጣቶችን በመፍጠር ላይ የሚውለው ሥራ የሚወሰነው በንጣፍ ውጥረት σ እና እኩል ነው
ወ 1 = 4πr 2 σ፣
4πr 2 ራዲየስ r ያለው የሉል ቅንጣቶች ገጽ ነው።
የኬሚካላዊው አቅም እንደሚከተለው ይለወጣል
Δμ = μ i // – μ i /< 0; μ i // >μ i /,
የት μ i / እና μ i // የሆሞ እና የተለያዩ ስርዓቶች (ከትንሽ ጠብታዎች ወደ ትላልቅ ሰዎች በሚሸጋገሩበት ጊዜ) የኬሚካል እምቅ ችሎታዎች ናቸው.
የኬሚካል እምቅ ለውጥ የአንድን የተወሰነ ክፍል ብዛት ከአንድ ደረጃ ወደ ሌላ ማስተላለፍን ያሳያል። ይህ ቁጥር n moles ከንጥሉ 4πr 3/3 በሞላር ድምጽ Vm የሚካፈል መጠን ጋር እኩል ነው።
በኮንደሬሽን ሂደት ውስጥ አዲስ ንጣፍ የመፍጠር ስራ W k እኩል ነው
የት W 1 እና W 2 በቅደም ተከተል, ወደ ቅንጣት ወለል ምስረታ ላይ ያወጡት ሥራ, እና አንድ ወጥ የሆነ መካከለኛ ወደ አንድ heterogeneous ጉዳዩን በማስተላለፍ ላይ ሥራ.
የተበታተኑ ስርዓቶች መፈጠር በአካላዊ እና በኬሚካላዊ ቅዝቃዜ ምክንያት እንዲሁም ፈሳሹን በሚተካበት ጊዜ ሊከሰት ይችላል.
የሰውነት መጨናነቅ የሚከሰተው የተለያዩ ንጥረ ነገሮች ትነት ያለው የጋዝ ሙቀት መጠን ሲቀንስ ነው። አስፈላጊዎቹ ሁኔታዎች ሲሟሉ, የተበታተነው ደረጃ ቅንጣቶች ወይም ጠብታዎች ይፈጠራሉ. ተመሳሳይ ሂደት የሚከናወነው በጋዝ መጠን ላይ ብቻ ሳይሆን በተቀዘቀዘ ጠጣር ወለል ላይ ነው, ይህም በሞቃት ጋዝ አካባቢ ውስጥ ይቀመጣል.
ኮንዳሽን የሚወሰነው በኬሚካላዊ አቅም ልዩነት ነው (μ i // - μ i /)< 0, которая изменяется в результате замены растворителя. В отличие от обычной физической конденсации при የሟሟ መተካትየተበታተነው መካከለኛ ስብጥር እና ባህሪያት ቋሚ አይሆኑም. የሰልፈር ፣ ፎስፈረስ ፣ ሮሲን እና አንዳንድ ሌሎች ኦርጋኒክ ንጥረ ነገሮች አልኮሆል ወይም acetone መፍትሄዎች በውሃ ውስጥ ከተፈሰሱ ፣ መፍትሄው ከመጠን በላይ ይሞላል ፣ ጤዛ ይከሰታል እና የተበታተኑ ክፍልፋዮች ይፈጠራሉ። የሟሟ መለዋወጫ ዘዴ ሶልሶችን ማግኘት ከሚችሉት ጥቂቶቹ አንዱ ነው.
በ የኬሚካል ኮንዲሽንየአንድ ንጥረ ነገር መፈጠር በአንድ ጊዜ ከመጠን በላይ መጨመር እና ማቀዝቀዝ ይከሰታል.
DISPERSE SYSTEMS የማግኘት ዘዴዎች - ጽንሰ-ሐሳብ እና ዓይነቶች. ምድብ እና ባህሪያት "የተበታተኑ ስርዓቶችን የማግኘት ዘዴዎች" 2017, 2018.
ሶል በጠንካራ ቅንጣት የተበታተነ ደረጃ ያለው የተበታተነ ስርዓት ነው። ኤሮሶል በጋዝ ከተበታተነ መካከለኛ ጋር ይዛመዳል፣ እና ሊዮሶል (ሃይድሮሶል) ፈሳሽ ከተበታተነ መካከለኛ ጋር ይዛመዳል።
ፈሳሾች መበተን ብዙውን ጊዜ በጋዝ ደረጃ ላይ በሚከሰትበት ጊዜ አቶሚዜሽን (atomization) ተብሎ የሚጠራ ሲሆን ከመጀመሪያው ጋር በማይመሳሰል ሌላ ፈሳሽ ውስጥ ሲተገበር ኢሚልሲንግ (emulsification) ይባላል።
መበታተን- ጠጣር ወይም ፈሳሽ ጥሩ መፍጨት ፣ በዚህም ምክንያትዱቄቶች፣ እገዳዎች፣ emulsions ( emulsification, ወይም emulsification). ጠጣር ነገሮች ሲበታተኑ, ሜካኒካዊ ጥፋታቸው ይከሰታል.የመበታተን ዘዴዎች
– ሜካኒካዊ መበታተን- በውጫዊ የሜካኒካል ሥራ ተጽዕኖ ስር ይከናወናል. ዘዴዎች፡ መሰባበር፣ መፍጨት፣ መለያየት፣ መርጨት፣ አረፋ (የአየር ዥረት በፈሳሽ ውስጥ ማለፍ)፣ መንቀጥቀጥ፣ ፍንዳታ፣ የድምፅ እና የአልትራሳውንድ ሞገዶች ተግባር። ይህ ዘዴ ዱቄት, ዱቄት ስኳር, የኮኮዋ ዱቄት, ቅመማ ቅመም, የተፈጨ ቡና እና ሌሎችም ለማምረት ያገለግላል. በዚህ ዘዴ የተገኙ ቅንጣቶች መጠን, c.p. በጣም ትልቅ, ቢያንስ 100 nm. መሳሪያዎች: ሞርታሮች, ወፍጮዎች, የተለያዩ ዓይነቶች ክሬሸርስ, ወፍጮዎች.
ቅልጥፍናን ለመጨመር ሜካኒካዊ ስርጭት በፈሳሽ ውስጥ ይካሄዳል. ጠንካራ ሰውነትን የሚያርቁ ፈሳሾች (surfactant መፍትሄዎች, ኤሌክትሮላይቶች) በላዩ ላይ ተጣብቀዋል እና በማሽን ጊዜ ጥንካሬን ይቀንሳሉ. ይህ የጠጣር ጥንካሬ መቀነስ ወይም የመልሶ ማቋቋም ውጤት(በ 1982 በ P.A. Rebinder የተመሰረተ)።
– የኤሌክትሪክ ስርጭት- በተቀዘቀዙ ዲኤስ ውስጥ በተቀመጠው የተረጨ ብረት በተሠሩ ኤሌክትሮዶች መካከል የቮልቴክ ቅስት በመፍጠር ላይ የተመሰረተ ነው. ብረቶች በቮልቴክ ቅስት የሙቀት መጠን ይተናል እና ከዚያም በብርድ ዲ.ኤስ. ይህ ዘዴ በዋነኛነት የብረት ሃይድሮሶልዶችን (የተከፋፈለው መካከለኛ ውሃ ነው) እንደ ብር, ወርቅ እና ፕላቲነም ያመርታል.
– የአልትራሳውንድ ስርጭት- በ 1 ሰከንድ ከ 20 ሺህ በላይ ድግግሞሽ ባለው የአልትራሳውንድ ንዝረት ተፅእኖ ላይ የተመሠረተ ፣ በሰው ጆሮ የማይታወቅ ፣ ዝቅተኛ ጥንካሬ ላላቸው ንጥረ ነገሮች ብቻ ውጤታማ። እነዚህም ሰልፈር, ግራፋይት, ስታርች, ጎማ, ጄልቲን, ወዘተ.
ወደ ፊዚኮ-ኬሚካልመበታተንተፈጻሚ ይሆናል። ዘዴ peptization. በልዩ ማረጋጊያ ተጨማሪዎች (ፔፕቲዘሮች - ኤሌክትሮላይቶች ፣ የሱርፋክታንት መፍትሄዎች) ተጽዕኖ ስር አዲስ የተዘጋጁ ልቅ ደለል ወደ ኮሎይድል መፍትሄ መለወጥን ያካትታል። የፔፕቲዘር ተግባር የዝቃጭ ቅንጣቶች እርስ በእርሳቸው ተለያይተው ተንጠልጥለው ሶል (ሶል) ይፈጥራሉ. ይህ ዘዴ ለምሳሌ ብረት (III) hydroxide hydrosol ለማግኘት ጥቅም ላይ ሊውል ይችላል). የፔፕታይዜሽን ዘዴ ጥቅም ላይ የሚውለው አዲስ ለተዘጋጁት ዝቃጮች ብቻ ነው, ምክንያቱም በማከማቻው ወቅት የ recrystalization እና የእርጅና ሂደቶች ስለሚከሰቱ, ቅንጣቶች እርስ በርስ እንዲዋሃዱ ያደርጋል. በዚህ ዘዴ የተገኙት ጥቃቅን መጠኖች 1 nm ያህል ናቸው.የተበታተኑ ስርዓቶችን ለማምረት ሁለት የታወቁ ዘዴዎች አሉ. በአንደኛው ውስጥ ጠንካራ እና ፈሳሽ ንጥረነገሮች በጥሩ ሁኔታ የተበታተኑ ናቸው (የተበታተኑ) በተገቢው ስርጭት ውስጥ ፣ በሌላኛው ደግሞ ከግለሰብ ሞለኪውሎች ወይም ionዎች የተበታተኑ ቅንጣቶች መፈጠር ምክንያት ናቸው።
ትላልቅ ቅንጣቶችን በመፍጨት የተበታተኑ ስርዓቶችን የማምረት ዘዴዎች ይባላሉ የሚበተን.በክሪስታልላይዜሽን ወይም በንፅፅር ምክንያት ቅንጣቶችን በመፍጠር ላይ የተመሰረቱ ዘዴዎች ይባላሉ ኮንደንስሽን.
23) የኮሎይድስ ባህሪያት.
ዓይነት I - suspensoids(ወይም የማይቀለበስ ኮሎይድስ, ሊዮፎቢክ ኮሎይድስ). የብረታ ብረት, ኦክሳይድ, ሃይድሮክሳይድ, ጨዎችን የኮሎይድ መፍትሄዎች. የተበታተነው ደረጃ የመጀመሪያ ደረጃ ቅንጣቶች ከተዛማጅ ንጥረ ነገር መዋቅር አይለያዩም እና ሞለኪውላዊ ወይም ionኒክ ጥልፍ አላቸው. እነዚህ የዳበረ interphase ወለል ጋር በጣም የተበታተኑ ስርዓቶች ናቸው. በተበታተኑበት ጊዜ ከእገዳዎች ይለያያሉ. ያለ ማረጋጊያ ለረጅም ጊዜ ሊኖሩ ስለማይችሉ ስማቸው ተሰይሟል።
ዓይነት II - ተባባሪ (ማይክላር ኮሎይድ) -ሴሚኮሎይድስ. የዚህ ዓይነቱ ቅንጣቶች የሚከሰቱት አነስተኛ ሞለኪውላዊ ክብደት ያላቸው ንጥረ ነገሮች በቂ መጠን ያለው አምፊፊሊክ ሞለኪውሎች ወደ ሞለኪውሎች ውህዶች - ማይክልሎች ስብስብ ሲኖር ነው። ሚኬልስ በመደበኛነት የተደረደሩ ሞለኪውሎች በተበታተኑ ኃይሎች አንድ ላይ የተከማቹ ስብስቦች ናቸው። የ micelles መፈጠር የተለመደ ነው የውሃ መፍትሄዎች ሳሙና እና አንዳንድ ኦርጋኒክ ማቅለሚያዎች. በሌሎች ሚዲያዎች እነዚህ ንጥረ ነገሮች ሞለኪውላዊ መፍትሄዎችን ለመፍጠር ይሟሟቸዋል.
III ዓይነት - ሞለኪውላር ኮሎይድስ - lyophilic (ግሪክ "ፊሊዮ" - ፍቅር). እነዚህም ከአስር ሺህ እስከ ብዙ ሚሊዮን የሞለኪውል ክብደት ያላቸው ተፈጥሯዊ እና ሰው ሠራሽ ከፍተኛ ሞለኪውላዊ ንጥረ ነገሮችን ያካትታሉ። የእነዚህ ንጥረ ነገሮች ሞለኪውሎች የኮሎይድል ቅንጣቶች መጠን አላቸው, ስለዚህ እንዲህ ያሉት ሞለኪውሎች ማክሮ ሞለኪውሎች ይባላሉ.
የኮሎይድ ቅንጣቶች ዋናው ገጽታ አነስተኛ መጠን ነው d: 1 nm< d < 10мкм
1) ዳያሊስስ.ለዲያሊሲስ በጣም ቀላሉ መሳሪያ - ዳያላይዘር - ከፊል-permeable ቁሳዊ (collodion) የተሠራ ቦርሳ ነው, ይህም የዲያላይዝድ ፈሳሽ የተቀመጠበት. ቦርሳው ፈሳሽ (ውሃ) ባለው ዕቃ ውስጥ ይወርዳል. በየጊዜው ወይም በየጊዜው በዲያላይዘር ውስጥ ያለውን መሟሟት በመቀየር የኤሌክትሮላይዶች እና ዝቅተኛ ሞለኪውላዊ ክብደት ያልሆኑ ኤሌክትሮላይቶች ከሞላ ጎደል ሙሉ በሙሉ ከኮሎይድ መፍትሄ ሊወገዱ ይችላሉ።
^2) ኤሌክትሮዳያሊስስ- በኤሌክትሪክ ጅረት ተግባር የተፋጠነ የዲያሊሲስ ሂደት። ኤሌክትሮዳያሊስስ በኤሌክትሮላይቶች የተበከሉ የኮሎይድ መፍትሄዎችን ለማጣራት ያገለግላል. ዝቅተኛ ሞለኪውላዊ ክብደት ካልሆኑ ኤሌክትሮላይቶች የኮሎይድ መፍትሄዎችን ለማጣራት አስፈላጊ ከሆነ የኤሌክትሮዳላይዜሽን ሂደት ውጤታማ አይደለም. የኤሌክትሮዳያሊስስ ሂደት ከተለመደው ዲያሊሲስ ትንሽ ይለያል.
^3) Ultrafiltration- የተበታተነ መካከለኛ እንዲያልፍ በሚያስችለው ከፊል-permeable ሽፋን በኩል የኮሎይድ መፍትሄዎችን በማጣራት
ዝቅተኛ ሞለኪውላዊ ክብደት ቆሻሻዎች እና የተበታተኑ የደረጃ ቅንጣቶችን ወይም ማክሮ ሞለኪውሎችን ማቆየት። የ ultrafiltration ሂደትን ለማፋጠን በሁለቱም የሽፋኑ ክፍሎች ላይ ባለው የግፊት ልዩነት ይከናወናል-በቫኩም ወይም
ከፍተኛ የደም ግፊት.
Ultrafiltration በግፊት ከሚደረግ ዳያሊስስ ያለፈ ነገር አይደለም።
24) የሃይድሮፎቢክ ኮሎይድል ስርጭት ስርዓቶች.
ሃይድሮፎቢክ ኮሎይድስ
የተበታተነው ንጥረ ነገር ከተበታተነው መካከለኛ (ውሃ) ጋር የማይገናኝባቸው የተበታተኑ ስርዓቶች. ሀይድሮፊሊቲቲ እና ሀይድሮፎቢሲቲን ይመልከቱ።
የተበታተኑ ስርዓቶች,የሁለት ወይም ከዚያ በላይ ደረጃዎች (አካላት) ምስረታ በመካከላቸው በጣም የዳበረ በይነገጽ። በዲ.ኤስ. ቢያንስ አንዱ ደረጃዎች - የተበታተነው ደረጃ - በትንሽ ቅንጣቶች (ክሪስታል, ክሮች, ፊልሞች ወይም ሳህኖች, ጠብታዎች, አረፋዎች) በሌላኛው, ቀጣይነት ያለው ደረጃ - የተበታተነ መካከለኛ. ዲ.ኤስ. እንደ ዋናው ባህሪው - የንጥል መጠን ወይም (ተመሳሳይ ነው) መበታተን (በኢንተርፋስ ወለል አጠቃላይ ስፋት እና በተበታተነው ደረጃ መጠን ላይ የሚወሰን) - በዝቅተኛ (ዝቅተኛ) የተበታተኑ እና የተበታተኑ ናቸው. በደቃቅ (በጣም) የተበታተኑ, ወይም ኮሎይድ ሲስተም (ኮሎይድስ). በጥራጥሬ ስርዓቶች ውስጥ, ቅንጣቶች ከ10 -4 የሚደርሱ መጠኖች አላቸው ሴሜእና ከፍተኛ, በኮሎይድ - ከ10 -4 -10 -5 እስከ 10 -7 ሴሜ.
25) ኤሌክትሮፊዮሬሲስ እና ኤሌክትሮስሞሲስ.
ኤሌክትሮስሞሲስ
በተቦረቦረ ሰውነት ውስጥ በተተገበረው እምቅ ልዩነት ተጽእኖ ስር ያለው ቀጥተኛ የፈሳሽ እንቅስቃሴ ኤሌክትሮሶሞሲስ ይባላል። ለምሳሌ በካፒታል ወይም በሜምብራል ቀዳዳዎች ውስጥ የኤሌክትሮላይት መንሸራተትን እንደ ምሳሌ እንመልከት። ለትክክለኛነቱ እናስብ አሉታዊ ionዎች በምድሪቱ ላይ ተጣብቀው የማይንቀሳቀሱ እና የተስተካከሉ ናቸው እና አዎንታዊ ionዎች የኢዲኤልን ስርጭት ክፍል ይመሰርታሉ። ውጫዊ መስክ E በመሬቱ ላይ ይመራል. በማንኛውም የዘፈቀደ አካል የኤዲኤል ስርጭት ክፍል ላይ የሚሠራው ኤሌክትሮስታቲክ ሃይል የዚህን ኤለመንት እንቅስቃሴ በገሃድ ላይ ያደርገዋል። በኤዲኤል ኤፍ (x) ክፍል ውስጥ ያለው የኃይል መጠን ወደ ላይኛው x ባለው ርቀት ላይ በመመርኮዝ ስለሚለዋወጥ የበሰበሰው የፈሳሽ ኤሌክትሮላይት ንብርብሮች በተለያየ ፍጥነት ይንቀሳቀሳሉ። ቋሚ ሁኔታ (በጊዜ ውስጥ የማያቋርጥ ፍሰት ፍጥነት) የሚከናወነው በዘፈቀደ የፈሳሽ ንብርብር ላይ የሚሠራው የኤሌክትሮስታቲክ ኃይል በተለያየ ርቀት ላይ በሚገኙ የንብርብር ፈሳሾች እንቅስቃሴ ፍጥነት ልዩነት ምክንያት በሚነሱ viscous የመቋቋም ኃይሎች ሲካስ ነው። ከመሬት ላይ. የሃይድሮዳይናሚክ እኩልታዎች የፈሳሹን ቋሚ የፈሳሽ viscosity እና የዳይኤሌክትሪክ ቋሚውን እንቅስቃሴ የሚገልጹ በትክክል ተፈትቷል ፣ የመፍትሄው ውጤት የፍሰት ፍጥነት ስርጭት ነው-
የፈሳሽ ፍሰቱ ፍጥነት ዜሮ በሚሆንበት (ተንሸራታች አውሮፕላን ተብሎ የሚጠራው) ከላዩ ርቀት ላይ ያለው የኤሌክትሪክ አቅም ዋጋ እዚህ አለ።
ኤሌክትሮፊዮራይዝስ
በተተገበረው እምቅ ልዩነት ተግባር ስር የተበታተነው ደረጃ ቅንጣቶች ቀጥተኛ እንቅስቃሴ ኤሌክትሮፊዮራይዝስ ይባላል።
በኤሌክትሮላይት ውስጥ ያለው የንጥሎች ኤሌክትሮፊክስ እንቅስቃሴ ከኤሌክትሮኦስሞሲስ ጋር ተመሳሳይነት ያለው ተፈጥሮ አለው-የውጭ የኤሌትሪክ መስክ የኢዲኤልን ተንቀሳቃሽ ክፍል ions ያስገባል ፣ ይህም ከቅንጣዎቹ አጠገብ ያሉ የፈሳሽ ንጣፎች ወደ ቅንጣቶች ወለል አንጻራዊ እንዲንቀሳቀሱ ያስገድዳቸዋል። ሆኖም በተገመገሙ ቅንጣቶች ውስጥ ባለው እጅግ በጣም አነስተኛ መጠን እና ትንሹነት ምክንያት, በጽናት ፈሳሽ ውስጥ ካለው ቅንጣቶች እንቅስቃሴ ጋር ወደ አንድ ቅንጣቶች እንቅስቃሴ ውስጥ ውጫዊ ኃይሎች በማይኖርበት ጊዜ ይዘታቸው. ኢዲኤል ያለው ቀጭን የእንቅርት ክፍል ጋር ሥርዓቶች ውስጥ ጠፍጣፋ ወለል ጋር ያልሆኑ conducting ቅንጣቶች, electrophoresis ፍጥነት electroosmotic ማንሸራተት ፍጥነት ጋር የሚገጣጠመው, ተቃራኒ ምልክት ጋር ይወሰዳል. ሉላዊ ቅንጣቶችን ለመምራት, የኤሌክትሮፊዮሬሲስ ፍጥነት ሊሆን ይችላል በቀመር የሚሰላው፡-
የንጥሉ የኤሌክትሪክ ማስተላለፊያ የት ነው.
26) የሶልስ ማይልስ መዋቅር.
የኮሎይዳል ሚሴል መዋቅር
ሊዮፎቢክ ኮሎይድስ በጣም ከፍተኛ የገጽታ ኃይል ስላለው በቴርሞዳይናሚካላዊ መልኩ ያልተረጋጋ ነው; ይህ የተበታተነውን ደረጃ ስርጭትን የመቀነስ ድንገተኛ ሂደትን ያስችላል (ማለትም ፣ ቅንጣቶችን ወደ ትላልቅ ስብስቦች በማጣመር) - የሶልስ የደም መርጋት.ሆኖም ፣ ሶሎች የተበታተነውን ደረጃ የመጠበቅ ተፈጥሯዊ ችሎታ አላቸው - አጠቃላይ መረጋጋት, ይህም በመጀመሪያ ደረጃ, በተበታተነው ደረጃ ቅንጣቶች ላይ ድርብ ኤሌክትሪክ ንጣፍ በመኖሩ ምክንያት የስርዓቱን የገጽታ ኃይል መቀነስ እና በሁለተኛ ደረጃ, በቅጹ ውስጥ የደም መርጋትን ለመከላከል የ kinetic መሰናክሎች በመኖራቸው ምክንያት ነው. ተመሳሳይ የኤሌክትሪክ ክፍያ ያላቸው የተበታተኑ የክፍል ቅንጣቶች ኤሌክትሮስታቲክ መባረር።
AgNO 3 + KI ––> AgI + KNO 3
27) የሃይድሮፎቢክ ሶልሶች መቆንጠጥ.
የሃይድሮፎቢክ መበታተን ስርዓቶች በኪነቲክ ድምር መረጋጋት ተለይተው ይታወቃሉ, በ coagulation ሂደት ፍጥነት ይወሰናል. የደም መርጋት እንቅስቃሴ የሚወሰነው በ Smoluchowski እኩልታ ነው-
ጠቅላላ የተበታተኑ የደረጃ ቅንጣቶች በጊዜ ብዛት የት አለ? τ ;
የንጥሎች የመጀመሪያ ብዛት; - ግማሽ የደም መርጋት ጊዜ; ^K- የደም መርጋት መጠን ቋሚ።
28) ከፍተኛ ሞለኪውላዊ ክብደት ውህዶች. መዋቅር. መፍታት እና እብጠት
ከፍተኛ ሞለኪውላዊ ክብደት ውህዶች (HMW) መፍትሄዎች
ከፍተኛ ሞለኪውላዊ ክብደት ውህዶች ከ10,000 እስከ ብዙ ሚሊዮን አሚ የሞለኪውል ክብደት ያላቸው ንጥረ ነገሮች ናቸው።
በተራዘመ ሁኔታ ውስጥ ያሉት የቢኤምሲ ሞለኪውሎች መጠኖች 1000 nm ሊደርሱ ይችላሉ, ማለትም. በ colloidal መፍትሄዎች እና በማይክሮ ሆቴሮጅን ሲስተም ውስጥ ከሚገኙት ጥቃቅን መጠኖች ጋር ተመጣጣኝ.
የቪኤምሲው የማብሰያ ነጥብ ከመበስበስ የሙቀት መጠን በእጅጉ ከፍ ያለ ነው ፣ ስለሆነም እነሱ እንደ አንድ ደንብ ፣ በፈሳሽ ወይም በጠንካራ ሁኔታ ውስጥ ብቻ ይኖራሉ።
IUD ማክሮ ሞለኪውሎች በመቶዎች እና በሺዎች የሚቆጠሩ በኬሚካል እርስ በርስ የተያያዙ አተሞች ያቀፉ ግዙፍ ቅርጾች ናቸው።
ሁሉም አይዩዲዎች በመነሻ ወደ ተፈጥሯዊ፣ በባዮኬሚካል ውህደት ወቅት የተፈጠሩ እና ሰው ሰራሽ፣ በፖሊሜራይዜሽን ወይም በፖሊኮንደንዜሽን የተገኙ ሰው ሰራሽ ወደሆኑ ሊከፋፈሉ ይችላሉ።
በፖሊሜር ሰንሰለት መዋቅር ላይ በመመስረት, IUDs ወደ መስመራዊ, ቅርንጫፍ እና ቦታ ይከፋፈላል.
ልክ እንደ ዝቅተኛ ሞለኪውላዊ ንጥረ ነገሮች እውነተኛ መፍትሄዎች፣ የኤች.ኤም.ሲ. ይህ ከ lyophobic colloidal systems ልዩነታቸው ነው. የቴርሞዳይናሚክስ መረጋጋት ምቹ በሆነ የ enthalpy እና entropy ምክንያቶች ሬሾ ምክንያት ነው።
ቪኤምሲዎች የተበታተኑ ስርዓቶች ባህሪያት በርካታ ባህሪያት አሏቸው: መጠናቸው ከሶልስ ቅንጣቶች (1-100 nm) መጠን ጋር ተመጣጣኝ የሆኑ ተባባሪዎችን ማፍራት ይችላሉ, የብርሃን መበታተን, የ emulsions, እገዳዎች እና አረፋዎች መፈጠርን ያበረታታሉ, ተለይተው ይታወቃሉ. በስርጭት እና ብራውንያን እንቅስቃሴ. በተመሳሳይ ጊዜ, ከሊዮፎቢክ ሶልስ በተቃራኒ, በ IUD መፍትሄዎች ውስጥ ምንም ልዩነት የለም, ማለትም. ትልቅ የፊት ገጽታ የለም.
ለ IUDs ልዩ የሆነ ንብረት ከሟሟ ጋር ሲገናኝ እብጠት ነው። እብጠት ውስን ወይም ያልተገደበ ሊሆን ይችላል. የኋለኛው ደግሞ ወደ ፖሊመር መሟሟት ይመራል.
ከፍተኛ የሞለኪውላር ክብደት ionዎችን ለመፍጠር በመፍትሔ ውስጥ የሚለያዩ ብዙ ቁጥር ያላቸው IUDዎች አሉ፤ እነሱም ፖሊአዴክትሮላይት ይባላሉ። እንደ ፖሊመር ቡድኖች ተፈጥሮ, ፖሊኤሌክትሮላይቶች cationic, anionic እና amphoteric ሊሆኑ ይችላሉ. የኋለኛው ደግሞ አሲዳማ እና መሰረታዊ ቡድኖችን ያካትታል. በአከባቢው ፒኤች ላይ በመመስረት እንደ አሲድ ወይም መሠረቶች ይለያያሉ. በፕሮቲን ሞለኪውል ውስጥ ያሉ አወንታዊ እና አሉታዊ ክፍያዎች የሚካካሱበት ሁኔታ ኢሶኤሌክትሪክ (ኢሶኤሌክትሪክ) ይባላል።